содержание .. 2 3 4 5 ..
Патологи́ческая анато́мия. Экзаменационные вопросы с ответами (2020 год)
1. В г. Ростове-на-Дону врачебное медицинское общество было воссоздано в 1915 г. путем слияния Ростовско-Нахичеванского и Варшавского медицинских обществ И. Ф. Пожариским, заведующим кафедрой патологической анатомии медицинского факультета Донского императорского университета, организованного на базе эвакуированного во время первой мировой войны Варшавского университета. Общество имело правление, в которое входили председатель и его заместители, секретарь, казначей и ревизионная комиссия. Сохранились вырезки из газет и воспоминания секретаря Г. Г. Жамгоцева о первом заседании общества врачей, на котором к присутствующим с речью обратился И.Ф.: « Научное медицинское общество при Варшавском университете, основанное в 1888 г, имело свою собственную библиотеку и регулярно издавало свои труды. Судьба Общества тесно связана с судьбой университета, на долю которого, особенно в последнее время выпало много невзгод и бурь… Я верю, что на новом месте общество скоро оправится и разовьет свою деятельность на пользу Родине!» — так закончил под аплодисменты присутствующих в большом количестве врачей и студентов он свое выступление. Не смотря на обстановку военного времени, удалось издать первую книгу трудов общества за 1915-1917 г.г.
И. Ф. Пожариский. имел
широкие научные интересы. Это был передовой энциклопедически
образованный ученый, создавший свою научно-педагогическую школу. Он
впервые описал бубонную форму чумы, особое внимание обратив на поражение
лимфатических узлов;
впервые проводил изучение действия удушающих отравляющих веществ на
организм человека; впервые утверждал о тесной связи гипертрофии и
регенерации; широко известны его работы по гетеротопическому образованию
костей и регенерации нервов, патологической анатомии сыпного тифа,
гриппа..
После безвременной смерти И. Ф. Пожариского от сыпного тифа в 1919 г. заведующим кафедрой патологической анатомии стал профессор Ш. И. Криницкий. Он продолжает работу в медицинском обществе, сохраняя тесную связь с клиницистами – профессорами Н. И. Напалковым и И. В. Завадским.
Ш. И. Криницкий и студенты
В 1921 году заведующим стал Шалва Иосифович Криницкий, который был учеником Пожариского И.Ф. Преемственность всегда была важнейшей чертой кафедры патологической анатомии. Шалва Иосифович был организатором патологоанатомической службы в г. Ростове-на-Дону, Ростовской области и на Северном Кавказе, по его инициативе были созданы 8 прозектур в крупных больницах города и 7 в области.
А в 1961 году заведующим становится Иван Иванович Дорохов, который являлся председателем Ленинградской Военно-медицинской академии. Студенческий научный кружок патологов продолжает работать все это время и все сотрудники кафедры, профессора и доктора наук, бывшие кружковцы.
Нельзя не отметить ценнейший вклад в науку кружковцами: в 1978 году ими была создана первая цитологическая лаборатория на базе кафедры патологической анатомии, которая в дальнейшем стала Городской цитологической лабораторией.
В 1990 году заведующей кафедрой становится ученица И.И. Дорохова Дерижанова Ирина Сергеевна. Необычная судьба Ирины Сергеевны связывает не одно поколение кружковцев. Ее отец Сергей Мартынович Дерижанов был учеником Криницкого Ш.И. и работал плечом к плечу с другими молодыми врачами, такими как З.Д.Ханина, Е.А.Кишкина, Н.И.Завадская и пр. После войны Сергей мартынович умер (оставив за собой поколение учеников и массу научных работ), а маленькую Ирину воспитала Елена Александровна Кишкина. Можно сказать, что ее вырастила кафедра. Ирина Сергеевна всегда была активным кружковцем, в дальнейшем его научным руководителем, председателем студенческого научного общества в течении 26-ти лет.
2. Биопси́я (от др.-греч. βίος — жизнь + ὄψις — внешний вид) — метод исследования, при котором проводится прижизненный забор клеток или тканей (биоптата) из организма с диагностической или исследовательской целью. Биопсия является обязательным методом подтверждения диагноза при подозрении на наличие онкологических заболеваний.
· По способу получения материала
· Забор материала для гистологического исследования
· Эксцизионная биопсия — забор для исследования патологического образования целиком.
· Инцизионная биопсия — забор для исследования части патологического образования либо диффузно измененного органа.
· Щипковая биопсия — с помощью биопсийных щипцов (punch-biopsy)
· Трепан-биопсия — забор столбика плотной ткани с помощью полой трубки с заостренным краем — трепана. Применяется для биопсии костей и плотных опухолей.
· Сердцевинная (core-биопсия, кор-биопсия, режущая биопсия) — забор столбика материала из мягких тканей при помощи специального трепана, состоящего из гарпунной системы и полой трубки с заостренным краем.
· Скарификационная (поверхностная) биопсия (shaving biopsy) — забор материала путём срезания с поверхности образования тонкого пласта ткани, применяется для биопсии патологических образований кожи.
· Петлевая биопсия — забор материала петлей при помощи коагулятора в режиме резания тканей либо радиочастотного хирургического аппарата. Применяется в ЛОР, гинекологии и при эндоскопических исследованиях.
· Забор материала для цитологического исследования
· Отпечаток с патологического образования (эрозии, язвы) — материал переносится на предметное стекло прикладыванием его к изъязвленной поверхности.
· Мазок-отпечаток с патологического образования — материал соскребается с патологического образования шпателем, скальпелем, цитощеткой затем переносится на предметное стекло.
· Тонкоигольная аспирационная биопсия (FNAB) — забор материала для исследования обычно с помощью пункционной иглы и шприца. Применяется как для биопсии кистозных образований, так и солидных опухолей.
· Аспирационная биопсия — вариант FNAB жидкостных образований: кист, забора жидкости из плевральной либо брюшной полости.
· По виду контроля точности:
· Классическая биопсия
· Прицельная биопсия
· Эндоскопическая
· Биопсия под контролем УЗИ
· Биопсия под рентгенологическим контролем
· Стереотактическая биопсия
Цели и задачи биопсии
Биопсия — наиболее достоверный метод исследования в случае необходимости установления клеточного состава ткани. Взятие тканей и последующее их исследование под микроскопом позволяет определить точный клеточный состав исследуемого материала. Биопсия является исследованием, входящим в диагностический минимум при подозрении на онкологическое заболевание, и дополняется другими методами исследования, такими как рентгенологические, эндоскопические, иммунологические.
Существенным обстоятельством, определяющим необходимость биопсии, является необходимость определить тактику лечения при онкологических заболеваниях. Лечение онкологических заболеваний требует выполнения травматичных, часто инвалидизирующих вмешательств: хирургических операций, лучевой терапии, введения токсичных химиотерапевтических препаратов, что не позволяет начинать лечения без достоверного подтверждения диагноза, которым является гистологическое либо цитологическое исследование биоптатов.
Например, при раке прямой кишки, расположенном в нижних отделах, радикальным методом лечения является выполнение брюшно-промежностной экстирпации прямой кишки — операции, предполагающей удаление прямой кишки и формирование колостомы (противоестественного заднего прохода). При отсутствии чёткой уверенности в диагнозе такую операцию выполнять нельзя. Если после операции выяснится, что злокачественной опухоли не было, закономерно встанет вопрос о напрасном выполнении травматичного вмешательства. То же самое касается рака молочной железы, рака желудка, рака легкого и других злокачественных опухолей.
Показания к проведению биопсии
Выполнение биопсии требуется при подозрении на заболевание, диагноз которого не может быть установлен достоверно или полноценно с помощью других методов исследования. Традиционно такими заболеваниями являются онкологические (опухолевые). Однако сегодня биопсия широко применяется в диагностике не опухолевых заболеваний. Прежде всего, в гастроэнтерологии (выявление микроскопических особенностей воспалительных и предопухолевых заболеваний пищевода, желудка, тонкой и толстой кишки, что в значительной степени определяет дальнейшую тактику и терапию) и гинекологии (определение эндокринных заболеваний и причин бесплодия по соскобам из полости матки, воспалительных и предопухолевых заболеваний шейки матки). Кроме этого, гистологическое исследование требуется для установления особенностей течения и тяжести поражения (а следовательно, и для прогноза и коррекции терапии) при заболеваниях некоторых органов (печени, почек, нервной и мышечной систем, а также некоторых сосудистых поражений). Однако диагностика этих состояний ограничивается техническими возможностями взятия и исследования материала, что обычно выполняется только в специализированных учреждениях и недоступно для районных или региональных центров.
3. Вскрытие (аутопсия).
Что такое вскрытие?
Вскрытие (секция, некропсия, аутопсия) - это посмертное исследование человека с целью установления изменений, вызванных заболеванием, и причин смерти. Во время вскрытия производится осмотр и исследование человеческих органов. Для этого вскрывают черепную коробку, грудную клетку и брюшную полость. Все результаты фиксируются в протоколе вскрытия.
Значение вскрытия в медицине
В средние века вскрытие трупов заложило основы анатомии человека, послужило предпосылкой для развития хирургии. Большинство знаний о микроскопическом строении тканей и внутренних органов было получено благодаря проведению вскрытия. При проведении вскрытий были получены важные данные о физиологии человека. Сегодня вскрытие проводят для установления причины смерти, в научных и учебных целях, а также в интересах судебного расследования.
Что изучают при проведении вскрытия?
Современные методы диагностики позволяют сегодня достаточно точно устанавливать диагноз заболевания. Однако посмертное вскрытие позволяет сравнить результаты вскрытия с диагнозом, установленным человеку при жизни. Кроме этого, клиническая аутопсия позволяет судить о степени эффективности проведенного лечения. Микроскопические и химические исследования дополняют материалы вскрытия. Благодаря электронному микроскопу можно увидеть самые незначительные изменения клеток. Возможно также выполнение анализа крови, устанавливающее различные инфекции. Иногда результаты анализа крови или ткани хранят в специальном архиве, для того чтобы через много лет при появлении более совершенных методов использовать данный материал для генетической или какой-либо другой диагностики.
В каких случаях вскрытие обязательно?
В Уголовном кодексе предусмотрены обстоятельства, при которых по решению судебных органов проводится обязательное вскрытие. Врач судебной медицинской экспертизы выполняет вскрытие при подозрении на насильственную смерть. Подобное вскрытие проводится даже при отсутствии согласия родных и близких умершего. Вскрытие обязательно, если больной страдал заразным заболеванием.
Судебное вскрытие
Судья или прокурор имеет право потребовать выполнения вскрытия в том случае, если человек умер неестественной смертью, и этому требуется подтверждение. При неустановленности личности умершего труп также подлежит судебно-медицинскому вскрытию. В процедуре вскрытия принимают участие два врача, один из которых является судебно-медицинским экспертом. Врач, лечивший пациента до его смерти, не имеет права участвовать во вскрытии.
В каких случаях вскрытие возможно?
Вскрытие проводится в медицинских целях - для уточнения или подтверждения диагноза. Для этого необходимо согласие близких умершего или его собственное согласие, подтвержденное завещанием. Представители лечебного учреждения и близкие покойного подписывают документ - акт, подтверждающий факт смерти человека, на основании которого проводится вскрытие. Процедура выполнения вскрытия регламентирована законом, предусматривающим как возможность отказа от вскрытия, так и право на его обязательное проведение.
Вскрытие по медицинским показаниям
Довольно часто бывают случаи, когда пациенты умирают собственной смертью, однако врачи при этом точно не знают, по каким причинам это произошло. В таких случаях вскрытие направлено на установление причин смерти. Сегодня посмертные исследования имеют меньшее значение, т.к. существуют и другие технические способы для установления диагноза. И все-таки по сей день аутопсия - один из важнейших источников обогащения медицинской науки.
Страховка и вскрытие
Если умерший был застрахован, то для осуществления выплаты необходимо проведение вскрытия, согласие на которое должны дать родственники. В случае отказа от вскрытия страховой полис теряет силу.
Донорство органов
Каждый человек вправе решить, что будет с его телом после смерти. Например, он может пожертвовать свое тело науке, для медицинских исследований, или стать донором. Если у человека есть паспорт донора, то это означает, что в случае его смерти, здоровые органы могут быть изъяты для пересадки.
4. объект исследования и методы патологической анатомии.
Патологическая анатомия занимается изучением структурных нарушений, возникших на самых начальных стадиях болезни, в ходе ее развития, вплоть до конечных и необратимых состояний или выздоровления. Это морфогенез болезни.
Патологическая анатомия изучает отклонения от обычного течения болезни, осложнения и исходы болезни, обязательно раскрывает причины, этиологию, патогенез.
Изучение этиологии, патогенеза, клиники, морфологии болезни позволяет применить научно-обоснованные меры лечения и профилактики болезни.
Результаты наблюдений в клинике, исследований патофизиологии и патологической анатомии показали, что здоровый организм животного обладает способностью сохранять постоянство состава внутренней среды, устойчивое равновесие в ответ на внешние факторы – гомеостаз.
При болезни гомеостаз нарушается, жизнедеятельность протекает иначе, чем в здоровом организме, что и проявляется характерными для каждой болезни структурными и функциональными нарушениями. Болезнь – это жизнь организма в изменившихся условиях как внешней, так и внутренней среды.
Патологическая анатомия изучает также изменения в организме. Под влиянием лекарств они могут быть положительными и отрицательными, вызывая побочные явления. Это патология терапии.
Итак, патологическая анатомия охватывает большой круг вопросов. Она ставит перед собой задачу дать четкое представление о материальной сущности болезни.
Патологическая анатомия стремится использовать новые, более тонкие структурные уровни и наиболее полную функциональную оценку измененной структуры на равных уровнях ее организации.
Патологическая анатомия получает материал о структурных нарушениях при болезнях с помощью вскрытия трупов, хирургических операций, биопсии и экспериментов. Кроме того, в ветеринарной практике с диагностической или научной целью проводят вынужденный убой животных в разные сроки заболевания, что дает возможность изучить развитие патологических процессов и болезни на различных стадиях. Большая возможность патологоанатомического обследования многочисленных туш и органов представляется на мясокомбинатах при забое животных.
В клинической и патоморфологической практике определенное значение имеют биопсии, т. е. прижизненное взятие кусочков тканей и органов, проводимое с научной и диагностической целью.
Особенно важным для выяснения патогенеза и морфогенеза болезней является воспроизведение их в эксперименте. Экспериментальный метод дает возможность создавать модели болезни для точного и детального их изучения, а также для испытания эффективности лечебных и профилактических препаратов.
Возможности патологической анатомии значительно расширились с применением многочисленных гистологических, гистохимических, авторадиографических, люминисцентных методов и т. д.
Исходя из задач, патологическая анатомия ставится в особое положение: с одной стороны, это теория ветеринарии, которая, раскрывая материальный субстрат болезни, служит клинической практике; с другой – это клиническая морфология для установления диагноза, служащая теории ветеринарии.
5. Что такое цитологическое исследование
Цитология — наука о клетке.
Цитологическое исследование — это метод изучения клеточного материала с целью установления диагноза доброкачественной или злокачественной опухоли и неопухолевых поражений.
Метод основан на исследовании с помощью микроскопа особенностей строения клеток, клеточного состава органов, тканей, жидкостей организма человека в норме и при патологических процессах, после чего дается общая оценка материала — цитологическое заключение.
С помощью цитологических исследований оценивают:
— состояние покровных тканей организма — кожи и слизистых оболочек, — из этих тканей могут формироваться раковые новообразования,
— гормональную активность,
— степень поражения опухолевых клеток при лечении злокачественных заболеваний,
-процесс заживления ран и другие процессы.
Что является материалом для цитологии
Характер и способ получения материала для исследований зависит от того, какой орган или ткань поражены:
· при заболеваниях кожи — соскобы и отпечатки с тканей;
· при заболеваниях щитовидной и молочной желез, органов кроветворения — пунктаты из участков поражения;
· при заболеваниях центральной нервной системы — спинномозговая жидкость;
· при заболеваниях легких — мокрота и так далее;
· при заболеваниях простаты — сок предстательной железы;
· при заболеваниях половых органов у женщин — мазки из шейки и полости матки;
· при заболеваниях суставов — жидкость из суставных и серозных полостей;
6. Патология клеточного ядра
Морфологически она проявляется в изменении структуры, размеров, формы и количества ядер и ядрышек, в появлении разнообразных ядерных включений и изменений ядерной оболочки. Особую форму ядерной патологии представляет патология митоза; с патологией хромосом ядра связано развитие хромосомных синдромов и хромосомных болезней.
Например, маргинация хроматина, т. е. расположение его под ядерной оболочкой, трактуется и как признак активности ядра, и как проявление его повреждения. Однако конденсация эухроматиновых структур (гиперхроматоз стенки ядра), отражающая инактивацию активных участков транскрипции, рассматривается как патологическое явление, как предвестник гибели клетки. К патологическим изменениям ядра относят также его дисфункциональное (токсическое) набухание, встречающееся при различных повреждениях клетки. При этом происходит изменение коллоидно-осмотического состояния ядра и цитоплазмы вследствие торможения транспорта веществ через оболочку клетки.
Форма ядер и их количество
Изменения формы ядра – существенный диагностический признак: деформация ядер цитоплазматическими включениями при дистрофических процессах, полиморфизм ядер при воспалении (гранулематоз) и опухолевом росте (клеточный атипизм).
Форма ядра может меняться также в связи с образованием множественных выпячиваний ядра в цитоплазму (рис. 3), которое обусловлено увеличением ядерной поверхности и свидетельствует о синтетической активности ядра в отношении нуклеиновых кислот и белка.
Изменения количества ядер в клетке могут быть представлены многоядерностью, появлением «спутника ядра» и безъядерностью. Многоядерность возможна при слиянии клеток. Таковы, например, гигантские многоядерные клетки инородных тел и Пирогова – Лангханса, образующиеся при слиянии эпителиоидных клеток (см. рис. 72). Но возможно образование многоядерных клеток и при нарушениях митоза – деление ядра без последующего деления цитоплазмы, что наблюдается после облучения или введения цитостатиков, а также при злокачественном росте.
Структура и размеры ядрышек
Изменения ядрышек имеют существенное значение в морфофункциональной оценке состояния клетки, так как с ядрышками связаны процессы транскрипции и трансформации рибосомальной РНК (р-РНК). Размеры и структура ядрышек в большинстве случаев коррелируют с объемом клеточного белкового синтеза, выявляемого биохимическими методами. Размеры ядрышек зависят также от функции и типа клеток.
Увеличение размеров и количества ядрышек свидетельствует о повышении их функциональной активности. Вновь образованная в ядрышке рибосомальная РНК транспортируется в цитоплазму и, вероятно, через поры внутренней ядерной мембраны. Интенсивный синтез белка в таких случаях подтверждается увеличением количества рибосом эндоплазматической сети.
Ядерные включения
Ядерные включения делят на три группы:
1. ядерные цитоплазматические
2. истинные ядерные
3. ядерные вирусобусловленные.
Ядерными цитоплазматическими включениями называют отграниченные оболочкой части цитоплазмы в ядре. Они могут содержать все составные части клетки (органеллы, пигмент, гликоген, капли жира и т. д.). Их появление в большинстве случаев связано с нарушением митотического деления.
Истинными ядерными включениями считают те, которые расположены внутри ядра (кариоплазмы) и соответствуют веществам, встречающимся в цитоплазме [белок, гликоген, липиды и т. д.]. В большинстве случаев эти вещества проникают из цитоплазмы в ядро через неповрежденные или поврежденные поры ядерной оболочки или через разрушенную ядерную оболочку. Возможно также проникновение этих веществ в ядро при митозе. Таковы, например, включения гликогена в ядрах печени при сахарном диабете («ядерный гликоген», «дырчатые, пустые, ядра»).
Вирусобусловленные ядерные включения (так называемые тельца ядерных включений) неоднозначны. Во-первых, это ядерные включения в кариоплазме кристаллической решетки вируса, во-вторых, включения белковых частиц, возникающих при внутриядерном размножении вируса; в-третьих, ядерные включения как проявление реакции на поражение вирусом цитоплазмы («реактивные включения»).
Ядерная оболочка
Ядерная оболочка выполняет ряд функций, нарушения которых могут служить основой для развития патологии клетки.
О роли ядерной оболочки в поддержании формы и размера ядра свидетельствует образование внутриядерных трубчатых систем, отходящих от внутренней ядерной мембраны, включений в перинуклеарной зоне [гипертрофия миокарда, легочный фиброз, системный васкулит, саркоидоз, опухоли печени, дерматомиозит].
О ядерной оболочке как месте прикрепления ДНК для облегчения репликации и транскрипции свидетельствует тот факт, что в ядерной оболочке имеются структуры, модулированные хроматином и в свою очередь ответственные за ориентацию и структуру хроматина. Показано, что функциональная активность ДНК связана с ее распределением при делении клетки и со степенью конденсации в интерфазе, причем повреждение оболочки может вызывать изменения таких участков распределения и быть причиной патологических изменений клетки.
7. Патология митоза
В жизненном цикле клетки митоз занимает особое место. С его помощью осуществляется репродукция клеток, а значит, и передача их наследственных свойств. Подготовка клеток к митозу складывается из ряда последовательных процессов: репродукции ДНК, удвоения массы клетки, синтеза белковых компонентов хромосом и митотического аппарата, удвоения клеточного центра, накопления энергии для цитотомии. В процессе митотического деления, как известно, различают 4 основные фазы: профазу, метафазу, анафазу и телофазу.
При патологии митоза может страдать любая из этих фаз. Руководствуясь этим, создана классификация патологии митоза [Алов И. А., 1972], согласно которой выделяются следующие типы патологии митоза:
I. Повреждение хромосом:
1. задержка клеток в профазе;
2. нарушение спирализации и деспирализации хромосом;
3. фрагментация хромосом;
4. образование мостов между хромосомами в анафазе;
5. раннее разъединение сестринских хроматид;
6. повреждение кинетохора.
II. Повреждение митотического аппарата:
1. задержка развития митоза в метафазе;
2. рассредоточение хромосом в метафазе;
3. трехгрупповая метафаза;
4. полая метафаза;
5. многополюсные митозы;
6. асимметричные митозы;
7. моноцентрические митозы;
8. К-митозы.
III. Нарушение цитотомии:
1. преждевременная цитотомия;
2. задержка цитотомии;
3. отсутствие цитотомии.
Патологию митоза могут вызвать различные воздействия на клетку: ультрафиолетовое и ионизирующее излучение, высокая температура, химические вещества, в том числе канцерогены и митотические яды и др. Велико количество патологических митозов при малигнизации тканей.
8. Хромосомные аберрации и хромосомные болезни
Хромосомные аберрации.
Под хромосомными аберрациями понимают изменения структуры хромосом, вызванные их разрывами, с последующим перераспределением, утратой или удвоением генетического материала. Они отражают различные виды аномалий хромосом. У человека среди наиболее часто встречающихся хромосомных аберраций, проявляющихся развитием глубокой патологии, выделяют аномалии, касающиеся числа и структуры хромосом. Нарушения числа хромосом могут быть выражены отсутствием одной из пары гомологичных хромосом (моносомия) или появлением добавочной, третьей, хромосомы (трисомия). Общее количество хромосом в кариотипе в этих случаях отличается от модального числа и равняется 45 или 47. Полиплоидия и анеуплоидия имеют меньшее значение для развития хромосомных синдромов. К нарушениям структуры хромосом при общем нормальном их числе в кариотипе относят различные типы их «поломки»: транслокадию (обмен сегментами между двумя негомологичными хромосомами), делецию (выпадение части хромосомы), фрагментацию, кольцевые хромосомы и т. д.
Хромосомные аберрации, нарушая баланс наследственных факторов, являются причиной многообразных отклонений в строении и жизнедеятельности организма, проявляющихся в так называемых хромосомных болезнях.
Хромосомные болезни.
Их делят на связанные с аномалиями соматических хромосом (аутосом) и с аномалиями половых хромосом (телец Барра). При этом учитывают характер хромосомной аномалии – нарушение числа отдельных хромосом, числа хромосомного набора или структуры хромосом. Эти критерии позволяют выделять полные или мозаичные клинические формы хромосомных болезней.
Хромосомные болезни, обусловленные нарушениями числа отдельных хромосом (трисомиями и моносомиями), могут касаться как аутосом, так и половых хромосом.
Моносомии аутосом (любые хромосомы, кроме Х- и Y-хромосом) несовместимы с жизнью. Трисомии аутосом достаточно распространены в патологии человека. Наиболее часто они представлены синдромами Патау (13-я пара хромосом) и Эдвардса (18-я пара), а также болезнью Дауна (21-я пара). Хромосомные синдромы при трисомиях других пар аутосом встречаются значительно реже. Моносомия половой Х-хромосомы (генотип ХО) лежит в основе синдрома Шерешевского-Тернера, трисомия половых хромосом (генотип XXY) – в основе синдрома Клейнфелтера. Нарушения числа хромосом в виде тетра- или триплоидии могут быть представлены как полными, так и мозаичными формами хромосомных болезней.
9. Митохондрии
Митохондрии являются наиболее лабильными внутриклеточными структурами. Они первыми подвергаются изменениям при гиперфункции клетки и различных ее повреждениях. Изменения митохондрий, возникающие при многих патологических процессах и болезнях, достаточно стереотипны, хотя ряд патологических состояний и болезней имеет специфические признаки повреждения митохондрий.
Изменения структуры, размеров, формы и числа митохондрий
Среди изменений структуры митохондрий наибольшее значение придается их конденсации и набуханию, а также появлению митохондриальных включений. Конденсация и набухание митохондрий могут отражать функциональное напряжение клетки, но чаще нарастающее кислородное голодание. Эти изменения нередко обратимы, однако, прогрессируя, ведут к тяжелой деструкции митохондрий и гибели клетки. Тогда к набуханию митохондрий присоединяются уплотнение их внутреннего пространства, деформация крист и потеря митохондриальных гранул, гомогенизация матрикса и появление в нем хлопьевидного материала, очагов обызвествления; в финале возникают разрывы наружной мембраны митохондрий.
Митохондриальные включения представлены хлопьевидным электронно-плотным материалом (липидные вещества), очагами обызвествления (гидроксиапатитоподобные кристаллы), миелиновыми фигурами, филаментоподобными и пластинчатыми структурами, белковыми кристаллами. Включения в митохондрии, как правило, встречаются при патологических состояниях, отражая неспецифическую реакцию митохондрий на повреждение клетки.
Размеры митохондрий колеблются в широких пределах – от гигантских до резко редуцированных форм. Гигантские митохондрии, которые образуются за счет гипертрофии или слияния митохондрий, встречаются только в патологических условиях. Такие митохондрии, нередко с кристаллическими включениями, как правило, обнаруживают, например, в гепатоцитах при алкоголизме. Митохондрии, в том числе и гигантские, могут быть различной формы: сигарообразные, каплеобразные, извитые и т. д.
Число митохондрий крайне вариабельно. Увеличение числа митохондрий (т. е. гиперплазия), отражающее усиление протекающего в них окислительного фосфорилирования, характерно для клеток с активацией специализированной функции, что имеет место при гипертрофии, пролиферации и трансформации клеток, особенно после повреждения ткани. Большое число митохондрий крайне характерно для онкоцитов, в том числе и онкоцитарных опухолей. Уменьшение числа митохондрий типично для так называемых регрессивных процессов – старения клеток, их атрофии.
10. Цитоскелет и патология клетки
«Скелет» клетки выполняет опорную, транспортную, контрактильную и двигательную функции. Он представлен 3 видами филаментов (фибрилл) – микрофиламентами, промежуточными филаментами и микротрубочками – макрофиламентами. Каждый из филаментов, выполняя ряд общих функций клетки, специализирован в отношении преимущественно одной из них – контракции (микрофиламенты), статики (промежуточные филаменты) или движения органелл и транспорта (микротрубочки). Цитоскелет претерпевает различные изменения при многих болезнях и патологических состояниях, что, естественно, влияет на специализированные функции клетки.
Микрофиламенты
Микрофиламенты имеют прямое отношение к актину и миозину. Актиновые филаменты, как и миозин, обнаружены почти во всех клетках. Для миозина, независимо от того, принадлежит он мышечным или немышечным клеткам, характерна одна способность – обратимо связываться с актиновыми филаментами и катализировать гидролиз АТФ, что требует присутствия самого актина. Количество миозина в мышечных клетках в 50 раз больше по сравнению с немышечными, кроме того, миозиновые филаменты мышечных клеток длиннее и толще, чем филаменты немышечных клеток.
Промежуточные филаменты
Промежуточные филаменты достаточно специализированы в зависимости от типа клеток, в которых встречаются: цитокератины находят в эпителиях, скелетин (десмин) – в мышечных клетках, виментин – в мезенхимальных клетках, нейрофиламенты – в клетках центральной и периферической нервной системы, глиальные филаменты – в клетках глии. Однако в клетках одного и того же происхождения могут встречаться промежуточные филаменты разного типа. Так, в гладких мышцах пищеварительной, дыхательной и мочеполовой систем промежуточные филаменты представлены главным образом скелетином, а в гладких мышечных клетках сосудов, как и во многих мезенхимальных клетках,- виментином. В связи с этим понятными становятся функциональные возможности гладких мышечных клеток сосудов (фагоцитоз, фибробластическая трансформация и др.).
Патологические изменения нейрофиламентов представлены образованием нейрофибриллярных сплетений, которые описаны при многочисленных патологических состояниях. Нейрофибриллярные сплетения вдоль аксонов периферических нервов и в нервных сплетениях характерны для своеобразного заболевания – наследственной нейропатии гигантских аксонов. Нейрофибриллярные сплетения лежат в основе так называемых сенильных бляшек головного мозга, патогномоничных для старческого слабоумия и болезни Альцгеймера. Однако в случаях появления амилоида в сенильных бляшках, т. е. при локальной церебральной форме старческого амилоидоза, нет оснований для заключения о том, что амилоид строят нейрофиламенты и их сплетения.
Микротрубочки
Как известно, микротрубочки выполняют множество разнообразных функций: определяют движение и ориентацию хромосом, митохондрий, рибосом, цитоплазматических гранул; принимают участие в секреции, митотическом делении клетки; осуществляют цитоплазматический транспорт. Не менее разнообразна и патология микротрубочек. При воздействии на микротрубочки рядом веществ, активирующих их функции (винбластин, изофлуран и др.), размеры микротрубочек увеличиваются в 2-3 раза. Они образуют скопления, связанные с рибосомами, к ним прилежат паракристаллические включения из гексогонально упакованных субъединиц. К тяжелому повреждению микротрубочек ведет ионизирующее излучение, при этом страдает генетический аппарат клетки, возникают патологические митозы. Резко уменьшается число микротрубочек (особенно в гепатоцитах) при воздействии этанолом, они округляются, вытесняются промежуточными филаментами.
11. Пластинчатый комплекс (комплекс Гольджи), секреторные гранулы и вакуоли
Синтетическая деятельность пластинчатого комплекса, тесно связанная с эндоплазматической сетью, завершается образованием секреторных гранул и вакуолей. Поэтому морфология нарушенной деятельности пластинчатого комплекса отражает и нарушения секреции, т. е. нарушения продукции клеточных включений – гранул и вакуолей. Можно говорить о двух основных морфологических проявлениях нарушенной деятельности пластинчатого комплекса и секретообразования: гипертрофии и атрофии.
Гипертрофия пластинчатого комплекса, т. е. его увеличение за счет гиперплазии его мембран, увеличения количества секреторных гранул, везикул и вакуолей, является проявлением повышенного синтеза и секреции белков, гликолипидов или полисахаридов. При этом увеличивается количество секреторных гранул и везикул в цитоплазме и за пределами пластинчатого комплекса.
Атрофия пластинчатого комплекса, т. е. уменьшение его размеров с редукцией компонентов, потерей секреторных гранул и вакуолей, свидетельствует о снижении его функциональной активности. Одной из причин такого снижения может быть недостаточность белковых запасов организма (белковое голодание); при этом эндоплазматическая сеть также атрофична, в цитоплазме мало секреторных гранул.
12. Альтерация
Альтерация —
повреждение ткани, определяет инициальную фазу воспаления, проявляется
различного вида дистрофиями клеток паренхимы и стромы органов вплоть до
некроза. Альтеративные изменения наиболее выражены в
высокодифференциро-ванных тканях, выполняющих сложные функции, например
в клетках центральной нервной системы, миелоидной ткани костного мозга,
в клетках проксимального и дистального отделов нефрона и др.
В то же время в тканях, выполняющих главным образом опорную функцию
и составляющих строму органа —
в соединительной ткани, волокнистых структурах, костной ткани,
альтеративные изменения обычно не достигают большой степени и
различаются с большим трудом в связи со стойкостью опорных тканей.
Ультраструктурные изменения клеток альтеративного характера при
воспалении наблюдаются в компонентах цитоплазмы, в ядре и ядрышке, в
мембранах. Изменяются форма и величина цистерн эндоплазматической сети,
появляются вакуоли, разрушаются мембраны и т.д. Митохондрии
увеличиваются, набухают. Некоторые митохондрии сморщиваются, матрикс
просветляется, кристы разрушаются. При повреждении лизосом
высвобождаются гидролитические ферменты, играющие значительную роль в
повреждении клеток и активации аденилциклазной системы.
13. Дистрофия (от греч. dys – нарушение и trophe – питаю) – сложный патологический процесс, в основе которого лежит нарушение тканевого (клеточного) метаболизма, ведущее к структурным изменениям. Поэтому дистрофии рассматриваются как один из видов повреждения.
Под трофикой понимают совокупность механизмов, определяющих метаболизм и структурную организацию ткани (клетки), которые необходимы для отправления специализированной функции. Среди этих механизмов выделяют клеточные и внеклеточные. Клеточные механизмы обеспечиваются структурной организацией клетки и ее ауторегуляцией. Это значит, что трофика клетки в значительной мере является свойством самой клетки как сложной саморегулирующейся системы. Жизнедеятельность клетки обеспечивается «окружающей средой» и регулируется с помощью ряда систем организма. Поэтому внеклеточные механизмы трофики располагают транспортными (кровь, лимфа, микроциркуляторное русло) и интегративными (нейроэндокринные, нейрогуморальные) системами ее регуляции. Из сказанного следует, что непосредственной причиной развития дистрофий могут служить нарушения как клеточных, так и внеклеточных механизмов, обеспечивающих трофику.
1. Расстройства ауторегуляции клетки могут быть вызваны различными факторами (гиперфункция, токсические вещества, радиация, наследственная недостаточность или отсутствие фермента и т. д.). Большую роль придают полому генов – рецепторов, осуществляющих «координированное торможение» функций различных ультраструктур. Нарушение ауторегуляции клетки ведет к энергетическому ее дефициту и к нарушению ферментативных процессов в клетке. Ферментопатия, или энзимопатия (приобретенная или наследственная), становится основным патогенетическим звеном и выражением дистрофии при нарушениях клеточных механизмов трофики.
2. Нарушения функции транспортных систем, обеспечивающих метаболизм и структурную сохранность тканей (клеток), вызывают гипоксию, которая является ведущей в патогенезе дисциркуляторных дистрофий.
3. При расстройствах эндокринной регуляции трофики (тиреотоксикоз, диабет, гиперпаратиреоз и т. д.) можно говорить об эндокринных, а при нарушении нервной регуляции трофики (нарушенная иннервация, опухоль головного мозга и т. д.) – о нервных или церебральных дистрофиях.
В классификации дистрофий придерживаются нескольких принципов. Выделяют дистрофии:
1. В зависимости от преобладания морфологических изменений в специализированных элементах паренхимы или строме и сосудах:
• паренхиматозные;
• стромально-сосудистые;
• смешанные.
2. По преобладанию нарушений того или иного вида обмена:
• белковые;
• жировые;
• углеводные;
• минеральные.
3. В зависимости от влияния генетических факторов:
• приобретенные;
• наследственные.
4. По распространенности процесса:
• общие;
• местные.
14. Морфологическая специфика .
При изучении дистрофий на разных уровнях – ультраструктурном, клеточном, тканевом, органном – морфологическая специфика проявляется неоднозначно. Ультраструктурная морфология дистрофий обычно не имеет какой-либо специфики. Она отражает не только повреждение органелл, но и их репарацию (внутриклеточная регенерация). Вместе с тем возможность выявления в органеллах ряда продуктов обмена (липиды, гликоген, ферритин) позволяет говорить об ультраструктурных изменениях, характерных для того или иного вида дистрофий.
Характерная морфология дистрофий выявляется, как правило, на тканевом и клеточном уровнях, причем для доказательства связи дистрофии с нарушениями того или иного вида обмена требуется применение гистохимических методов. Без установления качества продукта нарушенного обмена нельзя верифицировать тканевую дистрофию, т. е. отнести её к белковым, жировым, углеводным или другим дистрофиям. Изменения органа при дистрофии (размер, цвет, консистенция, структура на разрезе) в одних случаях представлены исключительно ярко, в других – отсутствуют, и лишь микроскопическое исследование позволяет выявить их специфичность. В ряде случаев можно говорить о системном характере изменений при дистрофии (системный гемосидероз, системный мезенхимальный амилоидоз, системный липоидоз).
15. необратимые повреждения.
Некроз
Некроз (от греч. nekros – мертвый) – омертвение, гибель клеток и тканей в живом организме; при этом жизнедеятельность их полностью прекращается. Некротический процесс проходит ряд стадий, что позволяет говорить о морфогенезе некроза:
1. паранекроз – подобные некротическим, но обратимые изменения;
2. некробиоз – необратимые дистрофические изменения, характеризующиеся преобладанием катаболических реакций над анаболическими;
3. смерть клетки, время наступления которой установить трудно;
4. аутолиз – разложение мертвого субстрата под действием гидролитических ферментов погибших клеток и макрофагов.
В морфологическом выражении некроз равнозначен аутолизу. Своеобразной формой некроза является апоптоз (от греч. аро – разделение и ptosis – опущение, падение). В основе апоптоза лежат разделение клетки на части с образованием апоптозных тел (фрагменты клетки, окруженные мембраной и способные к жизнедеятельности) и последующий фагоцитоз этих тел макрофагами.
Некробиотические и некротические процессы (некроз, апоптоз) происходят постоянно как проявление нормальной жизнедеятельности организма, так как отправление любой функции требует затрат материального субстрата, восполняемых физиологической регенерацией. Кроме того, большая часть клеток организма постоянно подвергается старению, естественной смерти с последующим их разрушением путем апоптоза и физиологического аутолиза.
Таким образом, в организме постоянно совершаются процессы физиологической деструкции, т. е. некротические, аутолитические и восстановительные, т. е. репаративные, регенераторные процессы, что обеспечивает нормальную его жизнедеятельность.
Некроз возникает чаще и раньше в функционально-активных паренхиматозных структурах (функционально отягощенные отделы миокарда, проксимальные и дистальные отделы почек, нейроны головного мозга и т. д.). Некрозу могут подвергаться часть клетки, клетка, группа клеток, участок ткани, органа, целый орган или часть тела. Поэтому в одних случаях он определяется лишь при микроскопическом исследовании, в других – хорошо различим невооруженным глазом.
Смерть, признаки смерти, посмертные изменения
Смерть как биологическое понятие является выражением необратимого прекращения жизнедеятельности организма. С наступлением смертй человек превращается в мертвое тело, труп (cadaver).
В зависимости от причины, ведущей к наступлению смерти, различают естественную (физиологическую), насильственную и смерть от болезней.
Естественная смерть наступает у людей старческого возраста и долгожителей в результате естественного (физиологического) изнашивания организма (,физиологическая смерть). Срок жизни человека не установлен, однако, если руководствоваться продолжительностью жизни долгожителей нашей планеты, он может составлять 150 лет и больше.
Насильственная смерть наблюдается в результате таких действий (умышленных или неумышленных), как убийство, самоубийство, смерть от различного рода травм (например, уличная, производственная или бытовая травма), несчастных случаев (например, транспортная катастрофа). Насиль-ственная смерть, являясь социально-правовой категорией, изучается судебной медициной и органами юстиции.
Клиническая смерть характеризуется остановкой дыхания и кровообращения, однако эти изменения жизнедеятельности организма в течение нескольких минут (время переживания коры головного мозга) обратимы. В основе клинической смерти лежит своеобразное гипоксическое состояние (прежде всего ЦНС) в связи с прекращением кровообращения и отсутствием центральной его регуляции.
Наступлению клинической смерти предшествует агония (от греч. agon – борьба), отражающая некоординированную деятельность гомеостатических систем в терминальном периоде (аритмии, паралич сфинктеров, судороги, отек легких). Поэтому агонию, которая может длиться от нескольких минут до нескольких часов, относят к так называемым терминальным состояниям, заканчивающимся клинической смертью. При терминальных состояниях (агония, шок, кровопотеря и т. д.) и клинической смерти используют комплекс реанимационных (от лат. re- и animatio – оживление) мероприятий. Основные закономерности угасания и восстановления жизненных функций человека изучает особый раздел медицины, называемый реаниматологией.
Биологическая смерть – необратимые изменения жизнедеятельности организма, начало аутолитических процессов. Однако гибель клеток и тканей при наступлении биологической смерти происходит не одновременно. Первой погибает ЦНС; уже через 5-6 мин после остановки дыхания и кровообращения происходит разрушение ультраструктурных элементов паренхиматозных клеток головного и спинного мозга. В других органах и тканях (кожа, почки, сердце, легкие и т. д.) этот процесс растягивается на несколько часов и даже суток, общая структура многих органов и тканей, наблюдаемая после смерти под световым микроскопом, довольно долго сохраняется, лишь при электронно-микроскопическом исследовании отмечается деструкция ультраструктур клеток. Поэтому патологоанатом, изучая микроскопически материал, взятый от трупа, может судить о характере патологических изменений органов и тканей.
Вскоре после наступления биологической смерти появляется ряд признаков смерти и посмертных изменений: охлаждение трупа; трупное окоченение; трупное высыхание; перераспределение крови; трупные пятна; трупное разложение.
16. Гиалиново-капельная дистрофия
При гиалиново-капельной дистрофии в цитоплазме появляются крупные гиалиноподобные белковые капли, сливающиеся между собой и заполняющие тело клетки; при этом происходит деструкция ультраструктурных элементов клетки. В ряде случаев гиалиново-капельная дистрофия завершается фокальным коагуляционным некрозом клетки.
Этот вид диспротеиноза часто встречается в почках, редко – в печени и совсем редко – в миокарде.
В почках при микроскопическом исследовании накопление гиалиновых капель находят в нефроцитах. При этом наблюдается деструкция митохондрий, эндоплазматической сети, щеточной каемки. В основе гиалиново-капельной дистрофии нефроцитов лежит недостаточность вакуолярно-лизосомального аппарата эпителия проксимальных канальцев, в норме реабсорбирующего белки. Поэтому этот вид дистрофии нефроцитов очень часто встречается при нефротическом синдроме. Этот синдром является одним из проявлений многих заболеваний почек, при которых первично поражается гломерулярный фильтр (гломерулонефрит, амилоидоз почек, парапротеинемическая нефропатия и др.).
Внешний вид почек при этой дистрофии не имеет каких-либо характерных черт, он определяется прежде всего особенностями основного заболевания (гломерулонефрит, амилоидоз).
В печени при микроскопическом исследовании в гепатоцитах находят гиалиноподобные тельца (тельца Мэллори), которые состоят из фибрилл особого белка – алкогольного гиалина. Образование этого белка и телец Мэллори служит проявлением извращенной белково-синтетической функции гепатоцита, что встречается постоянно при алкогольном гепатите и сравнительно редко при первичном билиарном и индийском детском циррозах, гепатоцеребральной дистрофии (болезни Вильсона-Коновалова).
Внешний вид печени различен; изменения характерны для тех ее заболеваний, при которых встречается гиалиново-капельная дистрофия.
Исход гиалиново-капельной дистрофии неблагоприятен: она завершается необратимым процессом, ведущим к некрозу клетки.
Гидропическая дистрофия
Гидропическая, или водяночная, дистрофия характеризуется появлением в клетке вакуолей, наполненных цитоплазматической жидкостью. Она наблюдается чаще в эпителии кожи и почечных канальцев, в гепатоцитах, мышечных и нервных клетках, а также в клетках коры надпочечников.
Микроскопическая картина: паренхиматозные клетки увеличены в объеме, цитоплазма их заполнена вакуолями, содержащими прозрачную жидкость. Ядро смещается на периферию, иногда вакуолизируется или сморщивается. Прогрессирование этих изменений приводит к распаду ультраструктур клетки и переполнению клетки водой. Клетка превращается в заполненные жидкостью баллоны или в огромную вакуоль, в которой плавает пузырьковидное ядро. Такие изменения клетки, которые по существу являются выражением фокального колликвационного некроза, называют баллонной дистрофией.
Внешний вид органов и тканей мало изменяется при гидропической дистрофии, она обнаруживается обычно под микроскопом.
Механизм развития гидропической дистрофии сложен и отражает нарушения водно-электролитного и белкового обмена, ведущие к изменению коллоидно-осмотического давления в клетке. Большую роль играет нарушение проницаемости мембран клетки, сопровождающееся их распадом. Это ведет к закислению цитоплазмы, активации гидролитических ферментов лизосом, которые разрывают внутримолекулярные связи с присоединением воды.
Причины развития гидропической дистрофии в разных органах неоднозначны. Впочках – это повреждение гломерулярного фильтра (гломерулонефрит, амилоидоз, сахарный диабет), что ведет к гиперфильтрации и недостаточности ферментной системы базального лабиринта нефроцитов, в норме обеспечивающей реабсорбцию воды; поэтому гидропическая дистрофия нефроцитов так характерна для нефротического синдрома. В печени гидропическая дистрофия возникает при вирусном и токсическом гепатитах (рис. 28) и нередко является причиной печеночной недостаточности. Причиной гидропической дистрофии эпидермиса может быть инфекция (оспа), отек кожи различного механизма. Вакуолизация цитоплазмы может быть проявлением физиологической деятельности клетки, что отмечается, например, в ганглиозных клетках центральной и периферической нервной системы.
Исход гидропической дистрофии, как правило, неблагоприятный; она завершается фокальным или тотальным некрозом клетки. Поэтому функция органов и тканей при гидропической дистрофии резко страдает.
17. Паренхиматозные жировые дистрофии (липидозы)
В цитоплазме клеток содержатся в основном липиды, которые образуют с белками сложные лабильные жиробелковые комплексы – липопротеиды. Эти комплексы составляют основу мембран клетки. Липиды вместе с белками являются составной частью и клеточных ультраструктур. Помимо липопротеидов, в цитоплазме встречаются и нейтральные жиры, которые представляют собой сложные эфиры глицерина и жирных кислот. Паренхиматозная жировая дистрофия встречается наиболее часто там же, где и белковая,- в миокарде, печени, почках.
В миокарде жировая дистрофия характеризуется появлением в мышечных клетках мельчайших жировых капель (пылевидное ожирение). При нарастании изменений эти капли (мелкокапельное ожирение) полностью замещают цитоплазму. Большинство митохондрий при этом распадается, поперечная исчерченность волокон исчезает. Процесс имеет очаговый характер и наблюдается в группах мышечных клеток, расположенных по ходу венозного колена капилляров и мелких вен.
Внешний вид сердца зависит от степени жировой дистрофии. Если процесс выражен слабо, его можно распознать лишь под микроскопом, применяя специальные окраски на липиды; если он выражен сильно, сердце выглядит увеличенным в объеме, камеры его растянуты, оно дряблой консистенции, миокард на разрезе тусклый, глинисто-желтый. Со стороны эндокарда видна желто-белая исчерченность, особенно хорошо выраженная в сосочковых мышцах и трабекулах желудочков сердца («тигровое сердце»). Эта исчерченность миокарда связана с очаговым характером дистрофии, преимущественным поражением мышечных клеток вокруг венул и вен. Жировая дистрофия миокарда рассматривается как морфологический эквивалент его декомпенсации.
В печени жировая дистрофия (ожирение) проявляется резким увеличением содержания жиров в гепатоцитах и изменением их состава. В клетках печени вначале появляются гранулы липидов (пылевидное ожирение), затем мелкие капли их (мелкокапельное ожирение), которые в дальнейшем сливаются в крупные капли (крупнокапельное ожирение) или в одну жировую вакуоль, которая заполняет всю цитоплазму и отодвигает ядро на периферию. Измененные таким образом печеночные клетки напоминают жировые. Чаще отложение жиров в печени начинается на периферии, реже – в центре долек; при значительно выраженной дистрофии ожирение клеток печени имеет диффузный характер.
Внешний вид печени достаточно характерен: она увеличена, дряблая, охряно-желтого или желто-коричневого цвета. При разрезе на лезвии ножа и поверхности разреза виден налет жира.
В почках при жировой дистрофии жиры появляются в эпителии проксимальных и дистальных канальцев. Обычно это нейтральные жиры, фосфолипиды или холестерин, который обнаруживают не только в эпителии канальцев, но и в строме. Нейтральные жиры в эпителии узкого сегмента и собирательных трубок встречаются как физиологическое явление.
Внешний вид почек: они увеличены, дряблые (при сочетании с амилоидозом плотные), корковое вещество набухшее, серое с желтым крапом, заметным на поверхности и разрезе.
Механизм развития жировой дистрофии почек связан с инфильтрацией эпителия почечных канальцев жиром при липемии и гиперхолестеринемии (нефротический синдром), что ведет к гибели нефроцитов.
Причины жировой дистрофии разнообразны. Чаще всего она связана с кислородным голоданием (тканевая гипоксия), поэтому жировая дистрофия так часто встречается при заболеваниях сердечно-сосудистой системы, хронических заболеваниях легких, анемиях, хроническом алкоголизме и т. д. В условиях гипоксии страдают в первую очередь отделы органа, находящиеся в функциональном напряжении. Вторая причина – инфекции (дифтерия, туберкулез, сепсис) и интоксикации (фосфор, мышьяк, хлороформ), ведущие к нарушениям обмена (диспротеиноз, гипопротеинемия, гиперхолестеринемия), третья – авитаминозы и одностороннее (с недостаточным содержанием белков) питание, сопровождающееся дефицитом ферментов и липотропных факторов, которые необходимы для нормального жирового обмена клетки.
18. В миокарде жировая дистрофия характеризуется появлением в мышечных клетках мельчайших жировых капель (пылевидное ожирение). При нарастании изменений эти капли (мелкокапельное ожирение) полностью замещают цитоплазму. Большинство митохондрий при этом распадается, поперечная исчерченность волокон исчезает. Процесс имеет очаговый характер и наблюдается в группах мышечных клеток, расположенных по ходу венозного колена капилляров и мелких вен.
Внешний вид сердца зависит от степени жировой дистрофии. Если процесс выражен слабо, его можно распознать лишь под микроскопом, применяя специальные окраски на липиды; если он выражен сильно, сердце выглядит увеличенным в объеме, камеры его растянуты, оно дряблой консистенции, миокард на разрезе тусклый, глинисто-желтый. Со стороны эндокарда видна желто-белая исчерченность, особенно хорошо выраженная в сосочковых мышцах и трабекулах желудочков сердца («тигровое сердце»). Эта исчерченность миокарда связана с очаговым характером дистрофии, преимущественным поражением мышечных клеток вокруг венул и вен. Жировая дистрофия миокарда рассматривается как морфологический эквивалент его декомпенсации.
Развитие жировой дистрофии миокарда связывают с тремя механизмами: повышенным поступлением жирных кислот в кардиомиоциты, нарушением обмена жиров в этих клетках и распадом липопротеидных комплексов внутриклеточных структур. Чаще всего эти механизмы реализуются путем инфильтрации и декомпозиции (фанероза) при энергетическом дефиците миокарда, связанном с гипоксией и интоксикацией (дифтерия). При этом основное значение декомпозиции не в высвобождении липидов из липопротеидных комплексов клеточных мембран, а в деструкции митохондрий, что ведет к нарушению окисления жирных кислот в клетке.
19.
В печени жировая дистрофия (ожирение) проявляется резким увеличением содержания жиров в гепатоцитах и изменением их состава. В клетках печени вначале появляются гранулы липидов (пылевидное ожирение), затем мелкие капли их (мелкокапельное ожирение), которые в дальнейшем сливаются в крупные капли (крупнокапельное ожирение) или в одну жировую вакуоль, которая заполняет всю цитоплазму и отодвигает ядро на периферию. Измененные таким образом печеночные клетки напоминают жировые. Чаще отложение жиров в печени начинается на периферии, реже – в центре долек; при значительно выраженной дистрофии ожирение клеток печени имеет диффузный характер.
Внешний вид печени достаточно характерен: она увеличена, дряблая, охряно-желтого или желто-коричневого цвета. При разрезе на лезвии ножа и поверхности разреза виден налет жира.
Среди механизмов развития жировой дистрофии печени различают: чрезмерное поступление в гепатоциты жирных кислот или повышенный их синтез этими клетками; воздействие токсических веществ, блокирующих окисление жирных кислот и синтез липопротеидов в гепатоцитах; недостаточное поступление в печеночные клетки аминокислот, необходимых для синтеза фосфолипидов и липопротеидов. Из этого следует, что жировая дистрофия печени развивается при липопротеидемии (алкоголизм, сахарный диабет, общее ожирение, гормональные расстройства), гепатотропных интоксикациях (этанол, фосфор, хлороформ и др.), нарушениях питания (недостаток белка в пище – алипотропная жировая дистрофия печени, авитаминозы, болезни пищеварительной системы).
20. Лизосомные болезни накопления
Лизосо́мные боле́зни накопле́ния (англ. Lysosomal Storage Diseases) — общее название группы весьма редкихнаследственных заболеваний, вызванных нарушением функции внутриклеточных органелл лизосом. Эти одномембранные органоиды, являются частью эндомембранной системы клетки и специализируются на внутриклеточном расщеплении веществ: гликогена, гликозаминогликанов, гликопротеинов и других. Лизосомные болезни накопления вызываются генетически обусловленным дефицитом ферментов лизосом, что приводит к накоплению макромолекул, являющихся субстратом этих ферментов, в различных органах и тканях организма.
Данная группа объединяет мукополисахаридозы, муколипидозы, гликогенозы, болезни накопления липидов,гликопротеинов и других макромолекул.
Клиническая картина
Предпосылками для проявления лизосомных болезней накопления являются различные генетические дефекты, которые ведут к развитию ферментопатии — недостаточности определённых ферментов, расщепляющих некоторые макромолекулы на уровне внутриклеточных органелл (лизосом). Лизосомные болезни накопления характеризуются:
· прогрессирующим течением,
· высокой инвалидизацией,
· высокой смертностью пациентов.
Наиболее характерными общими особенностями клинической картины для большинства лизосомных болезней накопления являются:
· органомегалия (преимущественно гепатомегалия и спленомегалия),
· костные аномалии,
· различной степени выраженности нарушения со стороны центральной нервной системы,
· грубые особенности строения волос и лица.
Классификация
В связи с тем, что при многих лизосомных болезнях накопления наблюдается сходная клиническая картина, их классифицируют в соответствии с типом вещества, которое накапливается (например, мукополисахаридозы, гликопротеинозы, сфинголипидозы)
21. Гиалиноз
При гиалинозе (от греч. hyalos – прозрачный, стекловидный), или гиалиновой дистрофии, в соединительной ткани образуются однородные полупрозрачные плотные массы (гиалин), напоминающие гиалиновый хрящ. Ткань уплотняется, поэтому гиалиноз рассматривается и как разновидность склероза.
Гиалин – это фибриллярный белок. При иммуногистохимическом исследовании в нем обнаруживают не только белки плазмы, фибрин, но и компоненты иммунных комплексов (иммуноглобулины, фракции комплемента), а также липиды. Гиалиновые массы устойчивы по отношению к кислотам, щелочам, ферментам, ШИК-положительны, хорошо воспринимают кислые красители (эозин, кислый фуксин), пикрофуксином окрашиваются в желтый или красный цвет.
Гиалиноз сосудов.
Гиалинозу подвергаются преимущественно мелкие артерии и артериолы. Ему предшествуют повреждение эндотелия, его мембраны и гладкомышечных клеток стенки и пропитывание ее плазмой крови.
Внешний вид.
При выраженном гиалинозе внешний вид органов изменяется. Гиалиноз мелких артерий и артериол ведет к атрофии, деформации и сморщиванию органа (например, развитие артериолосклеротического нефро- цирроза).
При гиалинозе собственно соединительной ткани она становится плотной, белесоватой, полупрозрачной (например, гиалиноз клапанов сердца при ревматическом пороке).
Исход.
В большинстве случаев неблагоприятный, но возможно и расса-сывание гиалиновых масс. Так, гиалин в рубцах – так называемых келоидах – может подвергаться разрыхлению и рассасыванию. Обратим гиалиноз молочной железы, причем рассасывание гиалиновых масс происходит в условиях гиперфункции желез. Иногда гиалинизированная ткань ослизняегся.
Функциональное значение.
Различно в зависимости от локализации, сте-пени и распространенности гиалиноза. Распространенный гиалиноз артериол может вести к функциональной недостаточности органа (почечная недоста-точность при артериолосклеротическом нефроциррозе). Местный гиалиноз (например, клапанов сердца при его пороке) также может быть причиной функциональной недостаточности органа. Но в рубцах он может не причинять особых расстройств.
22. Амилоид, строение, физико-химические свойства, методы диагностики, принципы классификации.
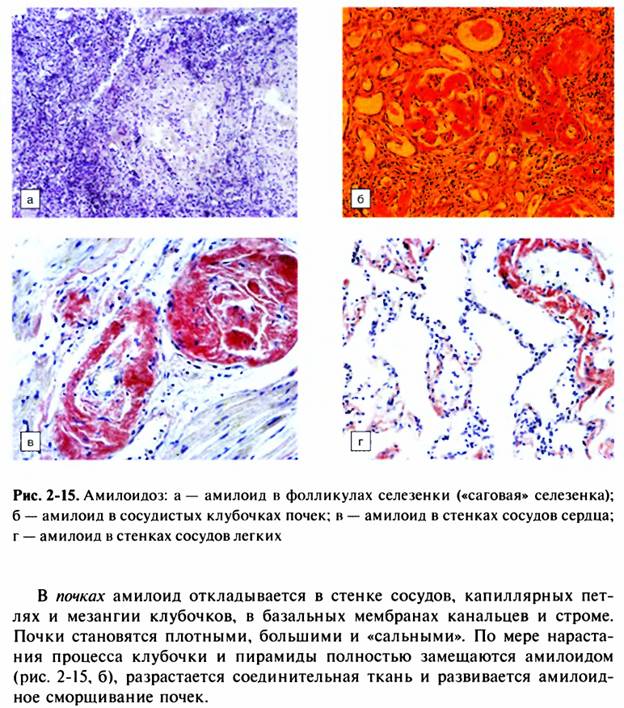
23. Вторичный амилоидоз: причины возникновения, изменения в органах, значение для организма.


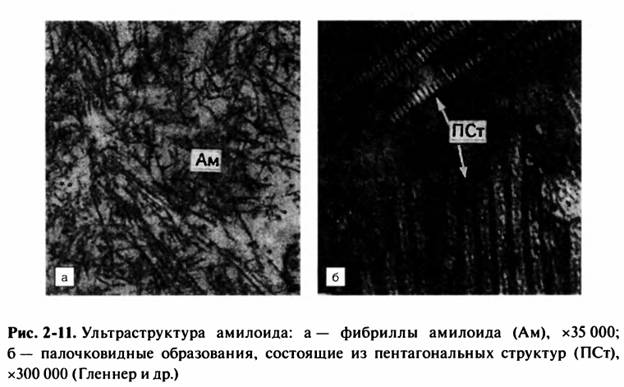






24. Общее и местное ожирение. Значение для организма





25. Эндогенные пигменты и пигментации. Классификация.
26. Местный и общий гемосидероз: причины, морфологическая характеристика, значение для организма.
28. Желтухи: виды, причины, изменения в органах, значение для организма.
29. Морфология нарушения обмена меланина: классификация, роль в патологии.

![]()
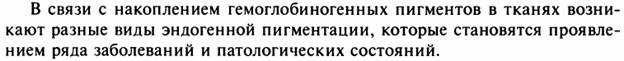
![]()

![]()
В условиях патологии наблюдают избыточное образование гемосидерина – гемосидероз, который имеет как общий, так и местный характер.
Общий, или распространенный гемосидероз наблюдают при внутрисосудистом разрушении эритроцитов – интраваскулярный гемолиз. Он встречается при болезнях системы кроветворения (анемии, гемобластозах), отравлениях гемолитическими ядами, некоторых инфекционных заболеваниях (возвратном тифе, бруцеллезе, малярии)Ю переливаниях иногруппной крови, резус_конфликте. Разрушенные эритроциты, их обломки, гемоглобин идут на построение гемосидерина. Сидеробластами становятся ретикулярные, эндотелиальные и гистиоцитарные элементы селе-



Билирубин – желчный пигмент, образование которого начинается в гистиоцитарной системе при разрушении гемоглобина и отщеплении от него гема.




и печень.








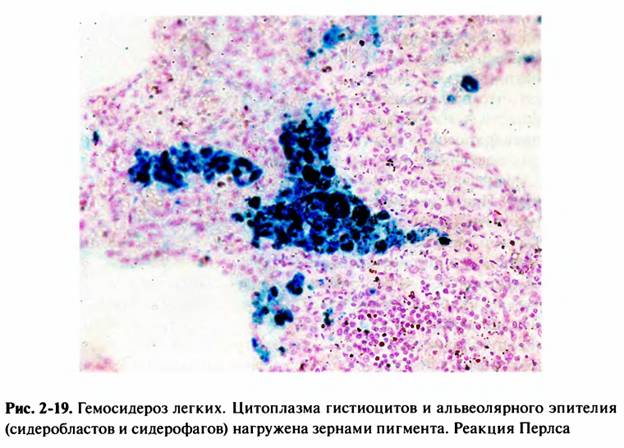
27. Бурое уплотнение легких: причины, морфологическая характеристика, значение для организма.
В морфогенезе бурого уплотнения легких основную роль играют застойное
полнокровие и гипертония в малом круге кровообращения, что ведет к
гипоксии и повышению сосудистой проницаемости, диапедезным
кровоизлияниям, «засорению» легкого плазменными белками и
гемоглобиногенными пигментами, к усилению тропоколлагеновой активности
фибробластов и склерозу легких.
Развитию этих изменений предшествует ряд адаптивных процессов в
сосудистом русле легких. В ответ на гипертонию малого круга
кровообращения возникает рефлекторное сужение легочных венул, а затем
артериол, позже происходит гипертрофия мышечно-эластических структур
мелких ветвей легочной вены и артерии с перестройкой сосудов по типу
замыкающих артерий, что предохраняет капилляры легкого от резкого
переполнения их кровью.
Со временем адаптивные изменения сосудов легкого сменяются
склеротическими, наступают декомпенсация легочного кровообращения,
переполнение капилляров межальвеолярных перегородок кровью.
Нарастает гипоксия ткани, в связи с чем повышается сосудистая
проницаемость, возникают множественные диапедезные кровоизлияния. В
альвеолах, межальвеолярных перегородках, лимфатических сосудах и узлах
легких появляются скопления нагруженных гемосидерином клеток —
сидеробластов и сидерофагов и свободнолежащих гемосидерина и ферритина.
Бурое уплотнение легких.
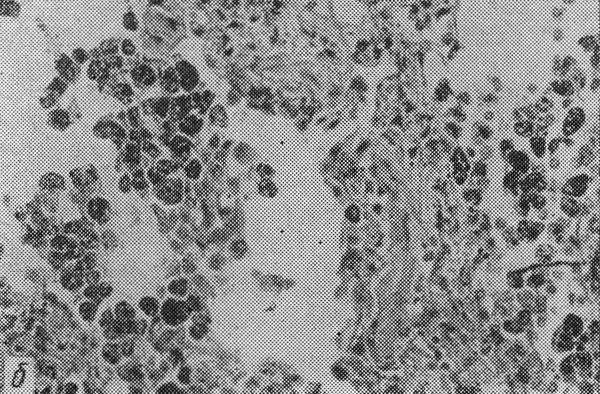
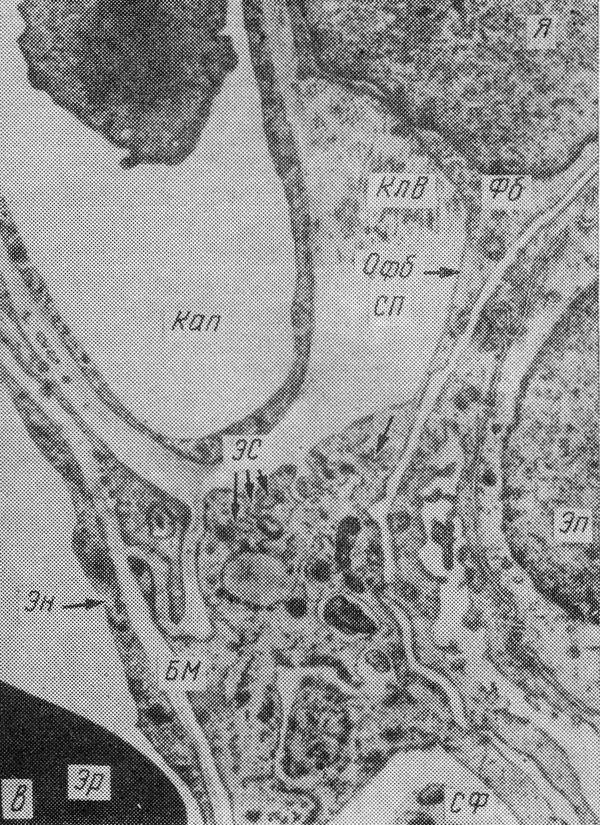
Бурое уплотнение легких: б — микроскопическая картина, сидерофаги в
просвете легочных альвеол, склероз альвеолярных перегородок, в —
электронограмма, в расширенном еептальном пространстве (СП) расположены
сидерофаг (СФ) и активный фибробласт (Фб), цитоплазма которого образует
длинный отросток (ОФб) и содержит много канальцев гранулярной
эндоплазматической сети (ЗС), свободных рибосом. Вблизи тела фибробласта
видны коллагеновые волокна (КлВ). Кап — капилляр, БМ — базальная
мембрана, Эк — эндотелий, Эп — альвеолярный эпителий, Эр — эритроцит, Я
— ядро. Х12 500.
Возникает диффузный гемосидероз легких. Гемосидерин, ферритин и белки
плазмы (фибрин) «засоряют» строму и лимфатические дренажи легких, что
ведет к резорбционной недостаточности их лимфатической системы, которая
сменяется механической. Склероз кровеносных сосудов и недостаточность
лимфатической системы усиливают легочную гипоксию, которая становится
причиной пролиферации фибробластов, утолщения межальвеолярных
перегородок.
Развивается склероз легких. Пневмосклероз при хроническом венозном
застое связан с активацией фибробластов, которые в большом количестве
обнаруживаются в септальных пространствах. Около их тел и длинных
отростков появляются коллагеновые волокна.
30. Нарушения обмена нуклеопротеидов (подагра, мочекислые инфаркты).

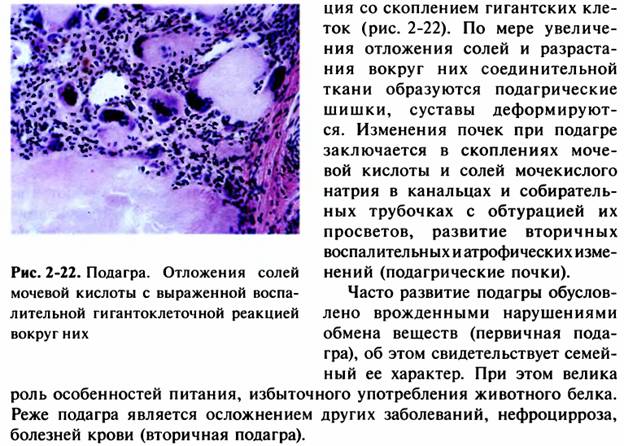

31. Нарушения обмена натрия и калия. Механизмы развития. Значение в патологии.


32. Кальцинозы: виды, патогенез, морфологическая характеристика.


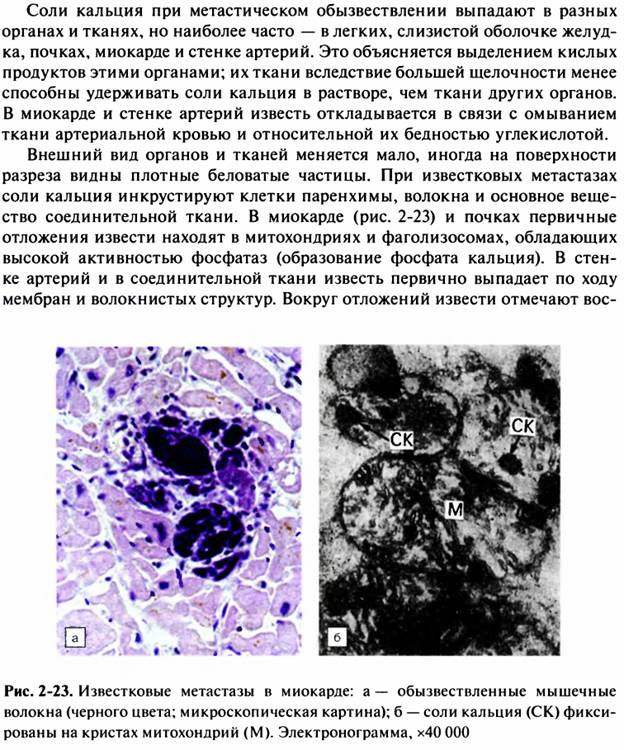
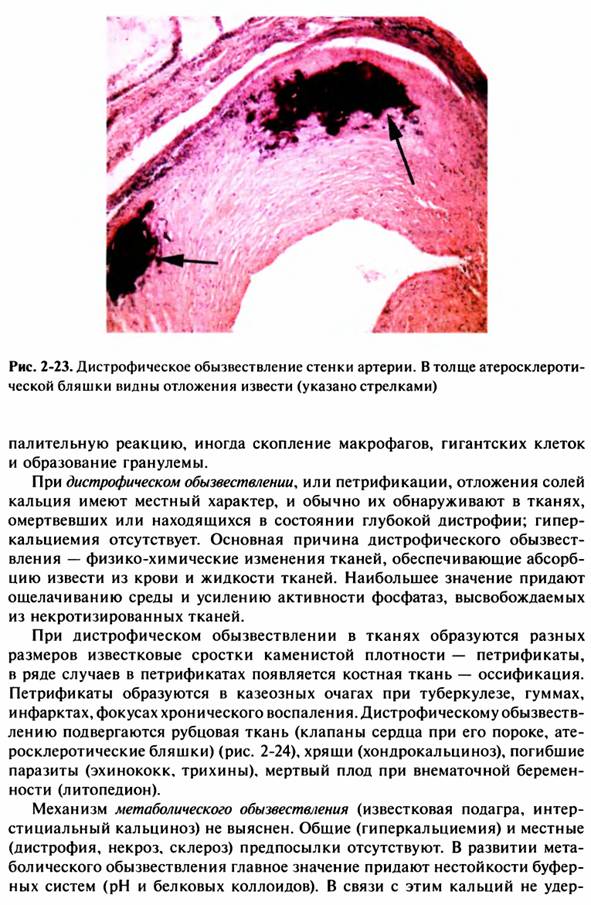

33. Причины и механизмы камнеобразования. Виды и морфология конкрементов мочеавыводящих и желчевыводящих путей.



43.Анемические инфаркты: их причины и локализация, значение для организма.
Инфаркт - очаг некроза в ткани или органе, возникающий вследствие прекращения или значительного снижения артериального притока, реже - венозного оттока. Инфаркт - это сосудистый (дисциркуляторный) некроз. Причинами инфаркта являются тромбоз, эмболия, длительный спазм артерии или функциональное перенапряжение органа в условиях недостаточного кровоснабжения (последнее наблюдается только при инфаркте миокарда)
Белый (анемический, ишемический)инфаркт- связан с закупоркой какой-либо артерии. Чаще всего это тромб или эмбол (эмболический инфаркт). Характеризуется он полным прекращением притока крови, вытеснением из участка инфаркта имеющейся крови в результате рефлекторного спазма сосудов в том числе коллатеральных . Поэтому участок омертвения становиться белым или бледно-серым с желтоватым оттенком, суховатым, без четко выраженного рисунка органа. Встречаются чаще всего в почках, селезенке реже в сердце и кишечнике.
Белый с геморрагическим ободком(поясом )инфаркт -возникает в тех случаях, когда после рефлекторного спазма коллатеральных сосудов наступает паралитическое расширение их с наполнением кровью мелких сосудов, расположенных по периферии инфаркта .В этой периферической зоне отмечают эритродиапедез и выпот отечной жидкости. Смешанные инфаркты встречаются в почках, миокарде, селезенке .
44.Геморрагические инфаркты: их причины, локализация, значение для организма.
Красный (геморрагический) инфаркт -возникает прежде всего закупорке артерий, а так же вен. В патогенезе важную роль играют двойной тип кровоснабжения и начиная венозного застоя (застойный инфаркт) .В связи повышенным притоком крови по анастомозам и коллатералям или застоем крови развивается гиперемия сосудов в участке инфаркта, но коллатеральное кровообращение остается недостаточным из-за низкого кровяного давления, и ткань подвергается омертвлению .Красные инфаркты выступают над органом, поверхность разреза их влажная, рисунок органа не сохраняется, цвет темно-красный .Они встречаются в легких, кишечнике, миокарде, селезенке и почках. Наиболее часто застойные инфаркты встречаются у лошадей, реже у других животных при динамическом перекручивании, инвагинации и странгуляциях петель кишечника в связи с поражением вен и развитием трансмуральных и интрамуральных инфарктов .
45.Тромбоз: определение понятия, причины, механизм формирования тромба, местные и общие факторы тромбообразования, классификация тромбов, их значение и исходы.
Тромбоз — прижизненное формирование внутри кровеносных сосудов сгустков крови препятствующих свободному потоку крови по кровеносной системе. Когда кровеносный сосуд повреждается, организм использует тромбоциты и фибрин для формирования сгустка крови (тромба), предотвращающего потерю крови. При определенных условиях сгустки крови могут образовываться в кровотоке даже без повреждения сосудов. Сгусток, который свободно циркулирует по всему кровеносному руслу, называется эмбол.
Причины:
состав крови (гиперкоагуляция или тромбофилия)
повреждение сосудистой стенки (повреждение клеток эндотелия)
характер кровотока (стаз, турбулентность)
46.Эмболия: определение, классификация, осложнения эмболий.
Эмболи́я — типовой патологический процесс, обусловленный присутствием и циркуляцией в крови или лимфе частиц, не встречающихся там в нормальных условиях (эмбол), нередко вызывающий окклюзию(закупорку) сосуда с последующим нарушением местного кровоснабжения.
Эмболия по характеру вызывающего её объекта подразделяется следующим образом:
эмболия твёрдыми частицами (ткани, микробы, паразиты, инородные тела);
тканевая и жировая эмболия встречаются преимущественно при обширных и тяжёлых травмах, переломах длинных трубчатых костей и т. д.;
эмболия жидкостями (околоплодные воды, жир, кофе с молоком[1]);
эмболия газами (в более частном случае воздушная эмболия) происходит при операциях на открытом сердце, ранениях крупных вен шеи и грудной клетки, а такжедекомпрессионных заболеваниях;
бактериальная эмболия связана с закупоркой сосудов скоплениями микробов;
эмболия инородными телами, в основном мелкими осколками при огнестрельных ранениях; нередко носит ретроградный характер;
эмболия, вызванная оторвавшимся тромбом или его частью, — тромбоэмболическая болезнь — имеет наибольшее практическое значение. Тромбы или их части (тромбоэмболы) из периферических вен оседают, как правило, в бассейне лёгочной артерии. В артериях большого круга эмболия обычно обусловлена отрывом тромботических наложений на клапанах или стенках левой половины сердца (при эндокардитах, пороках сердца, аневризме левого желудочка);
медикаментозная эмболия может произойти при инъекции масляных растворов подкожно или внутримышечно при случайном попадании иглы в сосуд. Масло, оказавшееся в артерии, закупоривает её, что приводит к нарушению питания окружающих тканей и некрозу.
47. Жировая эмболия, причины и значение, диагностика.
Жировая эмболия развивается при переломах или оперативных вмешательствах на костях (чаще голень, бедро, таз), обширных ушибах подкожной клетчатки у больных с избыточной массой тела, массивной (более 40% ОЦК) кровопотерей, при ожогах, некоторых отравлениях.
Механическая теория (жидкий жир из костного мозга попадает в кровеносное русло) и ферментативная теория (активация липазы нарушает дисперсность собственных жиров плазмы) также имеют право на существование, но большинство авторов относятся к ним критически. Клинические проявления жировой эмболии возникают через 24-48 часов после травмы или критического состояния.
При ранней диагностике жировой эмболии показано введение глюкокортикоидов (преднизолон 250-300 мг), которые подавляют агрегационные свойства клеток крови, снижают проницаемость капилляров, уменьшают перифокальную реакцию и отек тканей вокруг жировых эмболов.
Главным условием профилактики жировой эмболии является своевременное устранение гипоксии, ацидоза, адекватная коррекция кровопотери, эффективное обезболивание.
48.Воздушная и газовая эмболии: причины, значение.
Га́зовая эмболи́я — заболевание, возникающее вследствие прорыва стенок альвеол с капиллярами, что приводит к выносу воздушных пузырьков в кровеносное русло. Кровь приносит их в сердце, откуда они попадают в артерии большого круга кровообращения и достигают жизненно важных органов, препятствуя их нормальному кровоснабжению и повреждая стенки кровеносных сосудов.
Попадание пузырей в мозг вызывает потерю сознания, нарушение зрения, слуха, координации движения, паралич. Попадание воздуха в коронарные артерии приводит к инфаркту миокарда. Газы в подкожных сосудах вызывают появление на коже красно-белых пятен («мраморный» рисунок кожи).
Воздушная эмболия
Воздушная эмболия наиболее возможна при ранениях крупных вен с широким зиянием раны и во время операций на венах, производимых без должных предосторожностей. Речь идет чаще всего об операциях, предпринятых по поводу повреждений вен или артерио-венозных аневризм. Особую опасность в этом отношении представляют большие вены шеи, плечевого пояса и грудной полости, но известны случаи воздушной эмболии и при повреждении вен нижней конечности, таза. Кроме того, воздушная эмболия может развиться при ранении легкого или операции на нем. Даже при инсуффляции газа для наложения искусственного пневмоторакса, пневмоперитонеума, при артропневмографии и т. п. не исключена возможность воздушной эмболии (оставшееся незамеченным попадание иглы в просвет небольшой вены).
49.Тканевая и бактериальная эмболия: причины, значение.
Тканевая эмболия
Тканевая (клеточная) эмболия возможна при разрушении тканей в связи с травмой или патологическим процессом, что ведет к поступлению кусочков тканей (клеток) в кровь.
Эмболами могут быть
опухолевая ткань или комплексы клеток опухоли при ее распаде, кусочки
клапанов сердца при язвенном эндокардите, ткань головного мозга при
травме головы. Эмболия тканью головного мозга сосудов малого и большого
круга кровообращения возможна и у новорожденных при родовой травме. К
тканевой относят также эмболию амниотической жидкостью у родильниц.
Чаще тканевая (клеточная) эмболия наблюдается в сосудах большого круга,
реже — малого круга кровообращения. Особую категорию тканевой эмболии
составляет эмболия клетками злокачественной опухоли, так как она лежит в
основе гематогенного метастазирования опухоли.
Микробная эмболия
Микробная эмболия возникает в тех случаях, когда циркулирующие в крови
микробы закупоривают капилляры. Это могут быть комочки склеившихся
бактерий или грибов, животные паразиты, простейшие. Нередко
бактериальные эмболы образуются при гнойном расплавлении тромба.
Бактериальная эмболия определяет метастазирование гноя.
На месте закупорки сосуда бактериальными эмболами образуются
метастатические гнойники: при эмболии сосудов малого круга — в
легких, под плеврой, при эмболии сосудов большого круга — в почках,
селезенке, сердце и других органах.
50. Тромбоэмболия артерий малого круга кровообращения: виды, причины, значение для организма.
Под эмболией понимают острое перекрытие (окклюзию) просвета сосуда предметами или веществами, в норме не присутствующими в сосудистом русле. Эмболия бывает воздушной, жировой, тканевой, бактериальной и т.д. Тромбоэмболия — самый частый вид эмболии вены или артерии любого калибра. Она связана с осложненным течением тромбоза, в результате которого тромб отрывается от места своего формирования (венозная или артериальная стенка, сердце) и проникает в циркулирующую кровь. На фоне тромбоэмболии кровоток в том или ином сосуде прекращается, наблюдается развитие ишемии тканей, относящихся к бассейну данного сосуда. Соответственно, чем крупнее и важнее кровоснабжающий сосуд, тем тяжелее будут последствия тромбоэмболии. Если имеется склонность к образованию тромбов и к рецидивирующей тромбоэмболии, это состояние именуется как тромбоэмболическая болезнь
Наиболее опасно открепление тромбов в системе вен большого круга кровообращения, которые создают высокий риск возникновения тромбоэмболии легочной артерии (ТЭЛА). Закупорка тромбом сосуда головного мозга осложняется инсультом, тромбоэмболия коронарных сосудов — инфарктом миокарда, поражение глубоких и поверхностных вен ног — гангреной конечности, перекрытие сосудов спинного мозга — нарушением чувствительности и параличами. Если тромбоэмболия охватывает сосуды брюшины, возникает острая ишемия и инфаркт кровоснабжающихся органов. Может также происходит и остановка тромба в сосудах малого круга, что происходит намного реже.. Причины тромбоэмболии
Непосредственная причина возникновения тромбоэмболии — отрыв тромба. Он подобно пробке закрывает просвет сосуда, после чего развивается ишемия (кислородное голодание, обескровливание). Способность к формированию тромбов заложена в любом организме для того, чтобы остановить возникшее кровотечение. Но опасные тромбы, конечно, появляются не у всех. Чтобы патологический процесс был запущен, чаще всего необходимо повреждение сосуда, в связи с чем основные причины заболевания — травмы, операции на венах и артериях, установка катетера, сердечно-сосудистые патологии. В сочетании с повышенной свертываемостью и затруднением кровотока вероятность появления тромбов очень высока.
51. Тромбоэмболия артерий большого круга кровообращения: причины, значение для организма
При острой закупорке
(тромбоэмболия) брюшной аорты клинические проявления развиваются быстро:
появляются ишемические боли в ногах, кожа на которых становится бледной,
пульсация на периферических артериях отсутствует; активные движения ног
невозможны; чувствительность отсутствует. Если не обеспечены срочные
лечебные мероприятия, общее состояние больного быстро ухудшается,
учащается пульс и
резко снижается артериальное давление; сознание заторможено. Быстро
нарастает общая интоксикация; кожа нижних конечностей становится
мраморной с цианозом,
развивается влажная гангрена конечностей.
Возникновение тромбоэмболии подвздошной или бедренной артерии
сопровождается внезапным появлением сильных болей в соответствующей
конечности, состоянием коллапса, исчезновением пульсации ниже места
закупорки и усиленной пульсацией выше этого места. Без срочных лечебных
мероприятий быстро, на различном уровне, в зависимости от локализации
тромба, развивается гангрена конечности.
52. Кровотечения и кровоизлияние: виды, причины, исходы, значение для организма.
Кровотечение — прижизненное истекание крови из сердца или сосудов за пределы организма или в
его полости.
Кровоизлияние — скопление излившейся крови в тканях или замкнутых полостях.
Классификация.
По источнику кровотечения разделяют (с убывающей частотой) на
капиллярное,
венозное,
артериальное,
сердечное.
По механизму различают кровотечения:
от просачивания крови через внешне неизмененную стенку сосуда;
от разрыва сосуда;
от разъедания сосуда (опухолью, гноем или каким-либо химическим соединением).
Кровоизлияния в зависимости от их объема подразделяются на
Петехии — точечные кровоизлияния;
Экхимозы — плоские, обширные, неправильной формы;
Гематомы — значительные объемные.
Обширные в виде целых полей точечные кровоизлияния в коже, слизистых и серозных оболочках называют пурпурой.
Механизмы возникновения.
Диапедезные (кровотечения) кровоизлияния возникают при патологических состояниях, сопровождающихся
нарушением свертываемости крови,
повышением проницаемости капилляров,
повышении гидростатического давления в капиллярах.
Кровотечения (кровоизлияния) от разрыва сосуда возникают при
механическом его повреждении,
при резком повышении давления внутри сосуда (гипертонический криз, взрывная травма с распространением гидродинамической волны по сосудам),
при дистрофических и некротических изменениях стенки сосуда при васкулитах и пролежнях.
Массивное кровотечение, если оно своевременно не остановлено, может вести к смерти от кровопотери или к развитию острой постгеморрагической анемии. Кровотечение из сосудов головы, шеи, легких может сопровождаться аспирацией крови, приводящей к смерти от асфиксии, а в случае выживания пациента — к тяжелой аспирационной пневмонии. Хронические кровотечения (геморрой, язвенная болезнь, дисфункциональные маточные кровотечения и т.п.) осложняются развитием хронической постгеморрагической анемии.
Кровоизлияние в ткань головного мозга может вести к смерти за счет непосредственного поражения жизненноважных центров или за счет смещения головного мозга в большое затылочное отверстие и ущемления в нем продолговатого мозга. Двустороннее кровоизлияние в надпочечники ведет к смерти от острой сосудистой недостаточности. Кровоизлияние в проводящую систему сердца может оказаться смертельным за счет тяжелых нарушений ритма. Обнаружение кровоизлияний в рефлексогенных зонах при травмах (солнечное сплетение, корень легкого и др.) свидетельствует о наступлении летального исхода от рефлекторной остановки сердца.
содержание .. 2 3 4 5 ..