Фармация. Ответы к ситуационным задачам - часть 3
2017 год
СИТУАЦИОННАЯ ЗАДАЧА K002251
-
Череды трѐхраздельной трава - Bidentis tripartitae herba. Череда трѐхраздельная (Bidens tripartita). Астровые (Asteraceae).
-
Дикорастущее и культивируемое травянистое растение. Голарктический вид.
Широко распространен на территории России: по всей европейской части (кроме крайнего Севера), в Сибири, на юге Дальнего Востока.
Растѐт в лесной и лесостепной зонах, в изреженных лесах, среди кустарников, на болотах, сырых лугах, по берегам рек, ручьѐв и водоѐмов, сорно в огородах и на орошаемых полях.
Часто образует сплошные заросли.
Заготовки в промышленных масштабах возможны в Краснодарском и Ставропольском краях, для местных нужд – в Башкирии, Пермской, Псковской, Вологодской, Ярославской областях.
Культивируется в Краснодарском крае.
-
Вместе с чередой трѐхраздельной нередко встречается череда поникшая - Bidens cernua, не подлежащая заготовке.
Она отличается простыми, не разделѐнными на доли, сидячими, ланцетовидными, на верхушке длиннозаостренными, по краю пильчатыми листьями и поникающими корзинками, в которых, наряду с трубчатыми, имеются также и золотисто-жѐлтые краевые ложноязычковые цветки; ширина корзинок в 2-3 раза превышает высоту, а не равна ей; семянки ребристые, с 4(3), а не 2-3 остями.
-
Качественное обнаружение флавоноидов проводят методом тонкослойной хроматографии, полисахаридов - с помощью осадительной качественной реакции.
Содержание суммы флавоноидов в пересчѐте на рутин в траве череды проводят методом спектрофотометрии, содержание суммы полисахаридов - методом гравиметрии.
-
Трава череды обладает противовоспалительными и ранозаживляющими свойствами.
Применяется как диуретическое и потогонное средство, а также противоаллергическое средство в педиатрии, для лечения скрофулѐза, подагры, диатеза, фурункулѐза (лечебные ванны).
При наружном применении подсушивает раневую поверхность, способствует более быстрому заживлению поражѐнных участков кожи.
лекарственная форма - настой.
СИТУАЦИОННАЯ ЗАДАЧА K002252
1. В соответствии с действующим НД на сырьѐ черемухи обыкновенной содержание дубильных веществ в пересчѐте на танин и влажность сырья находятся в норме.
Однако в сырьѐ завышено содержание органической примеси; оно должно быть не более 1%.
Необходимо перебрать сырьѐ для удаления излишней органической примеси.
2. ГФ XIII, ФС.2.5.0049.15
-
Дикорастущий и культивируемый кустарник или дерево. Евроазиатский вид. Широко распространен в лесной и лесостепной зонах европейской части России,
Западной Сибири.
Отдельные местонахождения – на Кавказе. Растѐт в оврагах, по берегам рек, на долинных лугах, открытых склонах, в подлеске сырых смешанных, хвойных и лиственных лесов.
-
К 2 мл водного извлечения из плодов добавляют 1 мл железа (II) аммония сульфата раствора 1% и наблюдают темно-зеленое окрашивание – реакция на дубильные вещества конденсированного типа.
При стоянии выпадает тѐмный осадок.
Количественное содержание дубильных веществ определяют титриметрическим методом в пересчѐте на танин.
Титруют при постоянном перемешивании калия перманганата раствором в присутствии индикатора индигосульфокислоты до золотисто-желтого окрашивания.
-
Плодами (Fructus) в фармацевтической практике называют плоды различных морфологических типов, отдельные плодики, соплодия и их части.
Плоды собирают зрелыми и высушивают. Некоторые сочные плоды перерабатывают свежими.
СИТУАЦИОННАЯ ЗАДАЧА K002253
-
Все приведенные показатели соответствуют НД (ГФ XIII, ФС.2.5.0038.15), кроме количества частиц, не проходящих сквозь сито с отверстиями размером 7 мм: оно должно быть не более 5%.
Необходимо провести дополнительное измельчение сырья для уменьшения
количества крупных частиц.
-
Сенны листья - Sennae folia. Кассия остролистная - Cassia acutifolia. Кассия узколистная - Cassia angustifolia. Бобовые (Fabaceae).
-
Ксерофитный кустарник.
Произрастает в пустынях и полупустынях Судана, на побережье Красного мор, в южной Аравия, Сомали, Нубийской пустыне. Культивируется в Центральной Азии.
-
Листья сенны содержат антрагликозиды, агликонами которых являются алоэ-эмодин, реин, а также димеры реина (группа антрона), являющиеся стереоизомерами, которые получили название сеннозиды А и В.
-
Содержание суммы агликонов антраценового ряда в пересчѐте на хризофановую кислоту в листьях сенны определяют спектрофотометрическим методом.
Особенности:
экстракция проводится водой при нагревании;
затем проводится очищение от смолистых веществ органическим растворителем (эфиром);
окисление восстановленных форм проводят с помощью хлорида окисного железа; гидролиз С-гликозидов сенны проводят в жестких условиях, с использованием 50%
серной кислоты;
агликоны переэкстрагируют щелочно-аммиачным раствором; оптическую плотность измеряют при длине волны 523 нм.
СИТУАЦИОННАЯ ЗАДАЧА K002254
-
Все приведенные показатели соответствуют НД (ГФ XIII, ФС.2.5.0030.15), кроме количества пустых (без цветков) корзинок; оно должно быть не более 20%.
Необходимо перебрать сырьѐ для удаления избыточного количества пустых корзинок.
Но при этом возникает риск дальнейшего увеличения их содержания в связи с рассыпанием полных корзинок в процессе переборки.
Поэтому, возможно, более верным решением будет возврат сырья поставщику.
-
Однолетнее растение.
Встречается только в культуре, может давать самосев за границами территорий возделывания.
Основные районы промышленного возделывания в России - Краснодарский край и Поволжье.
-
Пустые корзинки (цветоложа с обертками) попадают в сырьѐ в том случае, если не вполне соблюден срок заготовки сырья.
Сырьѐ следует собирать в начале распускания трубчатых цветков, при горизонтальном положении язычковых цветков.
При опоздании со сбором может происходить в процессе сушки рассыпание цветков и образование пустых корзинок.
Их содержание следует нормировать, т.к. такие корзинки почти не содержат
действующие вещества, что приводит к снижению качества сырья.
-
Цветки содержат каротиноиды (до 3% в ложноязычковых цветках), флавоноиды.
Кроме того, в них присутствуют кумарины, дубильные вещества,
слизи,
эфирное масло, горечи (календен),
органические кислоты, тритерпеновые гликозиды, следы алкалоидов.
Содержание каротиноидов коррелирует со степенью махровости цветков.
-
Проявляют противовоспалительное, ранозаживляющее, бактерицидное действие.
Расслабляя гладкие мышцы желудочно-кишечного тракта, вместе с тем, возбуждают секреторную активность, способствуют усилению желчеобразования и желчеотделения.
Повышают секреторную, выделительную и метаболическую функцию печени: улучшают состав желчи, понижают концентрацию в ней билирубина и холестерина.
Как противовоспалительное, ранозаживляющее, спазмолитическое и желчегонное средство препараты календулы применяют при гастритах, язвенной болезни желудка и двенадцатиперстной кишки, колитах, энтероколитах, а также при воспалительно- дистрофических процессах слизистых оболочек и паренхиматозных тканей внутренних органов, в частности, при заболеваниях печени и желчных путей.
Наружно антисептические, противовоспалительные и ранозаживляющие свойства календулы используют при ангине, тонзиллите, для уменьшения кровоточивости дѐсен; в стоматологической практике - при болезнях полости рта (стоматиты, кандидозы, гингивиты, пародонтоз и др.); в гинекологической практике - для лечения эрозий шейки матки и трихомо-надных кольпитов.
Применяют при ушибах, порезах, инфицированных ранах, ожогах, фурункулах.
СИТУАЦИОННАЯ ЗАДАЧА K002255
1. ГФ XIII, ФС.2.5.0015.15.
-
Зверобой продырявленный и зверобой пятнистый (Hypericum perforatum, H. maculatum).
Зверобойные (Hypericaceae).
Дикорастущие и культивируемые травянистые многолетники. Евроазиатские виды.
Широко распространены в европейской части России (кроме северных районов), Западной и Восточной Сибири, на Кавказе.
Растут в лесной и лесостепной зонах на суходольных, реже на пойменных лугах, лесных опушках и полянах, в разреженных лесах, среди зарослей кустарников, в лесополосах.
В горах – до субальпийского пояса. Зверобой пятнистый более обычен в северных районах и Нечерноземье, чем зверобой продырявленный.
-
Стебли голые, с двумя или четырьмя рѐбрами.
Листья с многочисленными просвечивающими тѐмными железками или рассеянными прозрачными точками.
Чашелистики цельнокрайние, чѐрные железки отсутствуют или очень редки.
-
Трава зверобоя содержит группу конденсированных производных антрацена, представителями которых являются гиперицин и псевдогиперицин.
Терапевтический эффект связан также с наличием флавоноидов, дубильных веществ.
Помимо этого, в траве зверобоя содержатся эфирное масло, кумарины, каротиноиды, смолистые вещества.
-
Благодаря наличию флавоноидов трава зверобоя оказывает спазмолитическое действие на гладкие мышцы желчных протоков, кишечника, кровеносных сосудов и мочеточника.
Увеличивает отток желчи, препятствует застою желчи в желчном пузыре и тем самым предотвращает возможность образования камней.
Купирует спазмы толстых и тонких кишок, восстанавливает нормальную перистальтику, улучшая функционирование ЖКТ.
Дубильные вещества зверобоя оказывают легкое вяжущее и противовоспалительное действие, обладают антимикробной активностью по отношению к ряду микроорганизмов, устойчивых к действию антибиотиков.
Горькие вещества стимулируют желудочную секрецию.
Препараты зверобоя применяют при колитах, дискинезиях желчных путей, гепатитах, застое желчи в желчном пузыре, холециститах, начальных симптомах желчекаменной болезни, гастритах с секреторной недостаточностью, метеоризме, снижении фильтрационной способности почек, функциональной недостаточности почечных клубочков с задержкой жидкости и электролитов в организме, циститах.
Трава зверобоя обладает выраженной Р-витаминной активностью, уменьшает проницаемость капилляров, улучшает венозное кровообращение и кровоснабжение внутренних органов, повышает диурез в результате уменьшения напряжения стенок мочеточников и непосредственного увеличения фильтрации в почечных клубочках.
Конденсированные производные антрацена (гиперицин) проявляют выраженное психотропное действие.
С наличием гиперфорина связывают антидепрессантное и антибиотическое действие сырья зверобоя.
СИТУАЦИОННАЯ ЗАДАЧА K002256
-
В соответствии с ГФ III ФС.2.5.0051.15 в цельном сырьѐ шалфея лекарственного частиц, проходящих сквозь сито с отверстиями размером 0,5 мм, должно быть не более 5%.
В исследуемом образце показатель измельченности завышен.
Необходимо провести дополнительное измельчение и просеивание сырья для
удаления слишком крупных частиц.
-
Культивируемый полукустарник.
В России в диком виде не встречается. Родина – Малая Азия, откуда распространился по Средиземноморью и Балканскому полуострову.
Культивируется в Крыму, на Северном Кавказе. Шалфея лекарственного листья Salviae officinalis folia.
Шалфей лекарственный (Salvia officinalis). Яснотковые (Lamiaceae).
3. ГФ XIII, ФС.2.5.0033.15
-
Измельченность сырья определяют ситовым методом; размер частиц сырья указывают по диаметру отверстий используемого в анализе сита.
Измельченность нормируют по верхнему пределу.
Пробу сырья помещают на сито, указанное в соответствующей нормативной документации на лекарственное растительное сырьѐ, закрывают крышкой и осторожно, плавными вращательными движениями просеивают, не допуская дополнительного измельчения.
Просеивание измельченных частей считается законченным, если количество сырья, прошедшего сквозь сито при дополнительном просеве в течение 1 мин, составляет менее 1
% сырья, оставшегося на сите.
Для цельного сырья частицы, прошедшие сквозь сито, взвешивают и вычисляют их процентное содержание в массе аналитической пробы.
-
Основным компонентом эфирного масла шалфея лекарственного является цинеол, содержание которого доходит до 15%.
Он относится к моноциклическим монотерпеноидам.
СИТУАЦИОННАЯ ЗАДАЧА K002257
1. ГФ XIII, ФС.2.5.0032.15.
-
В соответствии с ГФ XIII влажность ЛРС (W) определяют по формуле: W = (m-m1)/m*100, где m – масса сырья до высушивания, г; m1 – масса сырья после высушивания, г.
В данном примере влажность сырья составила 12,9% для первой навески, 12,5% для второй навески.
Среднее значение двух параллельных определений – 12,7%.
-
В соответствии с ГФ XIII, ФС.2.5.0032.15 влажность сырья подорожника большого находится в пределах нормы.
Однако содержание полисахаридов в сырьѐ занижено – менее 12%.
Такое сырьѐ не реализуется через аптечные сети, а поступает на фармацевтические предприятия для производства галеновых препаратов и препаратов индивидуальных веществ.
-
В соответствии с ГФ XIII, ОФС.1.5.1.0003.15 листьями в фармацевтической практике называют лекарственное растительное сырьѐ, представляющее собой высушенные или свежие листья, или отдельные листочки сложного листа.
Листья собирают обычно вполне развитыми, с черешком или без черешка.
-
Для обнаружения полисахаридов в данном сырьѐ используются следующие
реакции:
-
осаждение полисахаридов 96%-ным этиловым спиртом;
-
кислотный гидролиз при нагревании на кипящей водяной бане в течение 10
минут и реакция с карбазолом на галактуроновую кислоту; наблюдается красно- фиолетовое окрашивание.
Для количественной оценки полисахаридов в данном сырьѐ используют гравиметрический метод. Проводят двукратную экстракцию полисахаридов водой очищенной при кипячении и последующее осаждение полисахаридов 96% этиловым спиртом. Осадок высушивают до постоянной массы.
СИТУАЦИОННАЯ ЗАДАЧА K002258
-
Культивируемый травянистый многолетник.
-
Встречается главным образом на Кавказе, в Крыму и Карпатах (Зап. Украина). Произрастает в горных широколиственных, преимущественно буковых, лесах. Культивируется в Крыму и Краснодарском крае.
В настоящее время сырьѐ заготавливают только от культивируемых растений.
2. ГФ XIII, ФС.2.5.0020.15.
-
В траве красавки содержатся алкалоиды – производные тропана (0,05-0,8%). Основными алкалоидами красавки являются L-гиосциамин, а также скополамин.
В процессе первичной переработки сырья и выделения алкалоидов L-гиосциамин частично переходит в правовращающий изомер - D-гиосциамин.
Рацемическая смесь право- и левовращающих изомеров называется атропином.
Кроме того, трава красавки содержит стероиды, фенольные кислоты и их производные, флавоноиды, оксикумарины, алифатические спирты.
Обнаружение алкалоидов проводят с помощью качественных реакций с общеалкалоидными осадительными реактивами и методом тонкослойной хроматографии.
Сумму алкалоидов в пересчѐте на гиосциамин в траве красавки определяют методом обратного водного титрования.
-
Клетки эпидермиса с извилистыми боковыми стенками и складчатой кутикулой.
Устьица анизоцитного типа.
Головчатые волоски двух типов: с длинной многоклеточной ножкой и одноклеточной головкой, с одноклеточной ножкой и многоклеточной (4-6 клеток) головкой.
Простые волоски 2-3-(реже 6)-клеточные, с тонкими стенками.
В губчатой паренхиме видны овальные клетки, заполненные кристаллическим песком оксалата кальция.
Иногда встречаются отдельные друзы и призматические кристаллы оксалата кальция.
Эпидермис лепестков с сосочковидными выростами и складчатой кутикулой.
-
Сбор травы проводят с начала фазы бутонизации до наступления массового плодоношения, 2-5 раз за вегетационный сезон.
Сушат сырьѐ в воздушных или тепловых сушилках при температуре не выше 40-45
°С.
Хранят сырьѐ в отдельном помещении или отдельном шкафу, под замком, при
температуре не выше 15°С и относительной влажности воздуха 30-50%.
СИТУАЦИОННАЯ ЗАДАЧА K002259
-
В соответствии с ГФ XIII, ФС.2.5.0012.15 в сырьѐ завышено содержание органической примеси.
Необходимо перебрать сырьѐ для удаления еѐ избытка.
Содержание минеральной примеси и суммы флавоноидов находится в пределах нормы.
-
Дикорастущий травянистый многолетник. Евроазиатский вид.
Произрастает по всей европейской части России (кроме Крайнего Севера), на Кавказе, юго-западе Сибири.
Предпочитает сухие открытые каменистые места, сухие леса, суходольные и пойменные луга, встречается между кустарниками, на лесных полянах, опушках.
Местами образует небольшие заросли.
Основные районы заготовок – в средней полосе РФ; возможны заготовки на Алтае.
-
Трава содержит эфирное масло (0,3-1,2%), в состав которого входит тимол и его изомер карвакрол,
монотерпеноиды (геранилацетат),
бициклические и трициклические сесквитерпеноиды; дубильные вещества,
флавоноиды, аскорбиновая кислота.
-
Заготавливают сырьѐ в сухую погоду в фазе цветения, срезая облиственные цветущие верхушки длиной до 20 см.
При правильном сборе на одном и том же массиве можно проводить заготовку 2-3 года подряд.
Сушат в хорошо проветриваемых помещениях или в сушилках при температуре не выше 40 °С.
Хранят отдельно от других видов ЛРС (как эфирномасличное сырьѐ).
-
Определение суммы флавоноидов в сырьѐ проводили методом дифференциальной спектрофотометрии с использованием раствора алюминия хлорида.
Определение содержания эфирного масла проводили методом гидродистилляции, в соответствии с ГФ XIII, ОФС.1.5.3.0010.15, «Определение содержания эфирного масла в лекарственном растительном сырьѐ и лекарственных растительных препаратах», (метод 2).
СИТУАЦИОННАЯ ЗАДАЧА K002262
-
ЛП изготовлен неудовлетворительно, так как фармацевт допустил существенные ошибки, отразившиеся на его качестве:
-
в качестве основы мази следовало использовать вазелин, а не вазелин-ланолин безводный 9:1;
-
концентрация резорцина в мази больше 2%, поэтому во избежание токсического действия его следовало вводить в виде суспензии, а не в виде эмульсии.
-
-
Расчѐты.
М цинка оксида = 20,0×10,0:100,0=2,0. М вазелина = 20,0–2,0=18,0.
М общая = 20,0+0,5=20,5.
С резорцина = 0,5×100%:20,5=2,44%, что больше 2%. Значит резорцин вводят по типу суспензии.
С суспензионной фазы = (2,0 + 0,5) ×100%:20,5=12,2%, что больше 5%. Пульпу получают с частью расплавленного в тѐплой ступке вазелина по правилу Дерягина.
-
К обязательным видам внутриаптечного контроля экстемпоральных ЛП относятся: письменный, органолептический и контроль при отпуске.
Письменный контроль предполагает оформление паспорта письменного контроля (ППК) сразу после изготовления ЛФ, по памяти, на латинском языке, в технологической последовательности. ППК хранятся в аптеке 2 месяца. В ППК указывают дату, номер рецепта, взятые ЛВ и ВВ и их количества, общий объѐм или массу, число доз, подписи изготовившего, расфасовавшего и проверившего ЛП. На обратной стороне ППК делают расчѐты.
Органолептический контроль заключается в проверке внешнего вида, запаха, однородности, отсутствия механических включений, вкуса (выборочно ЛП для детей).
Контроль при отпуске предполагает проверку соответствия упаковки физико- химическим свойствам ингредиентов; номера на рецепте и на этикетке; фамилии больного на рецепте, этикетке и на квитанции; оформления ЛП действующим требованиям.
-
ППК.
Дата, № рецепта. Zinci oxydi 2,0.
Resorcini 0,5.
Vaselini 18,0.
М общая 20,5. М баночки = Приготовил. Проверил.
-
Мази хранят в прохладном, защищѐнном от света месте. Срок хранения – 10
суток.
СИТУАЦИОННАЯ ЗАДАЧА K002385
-
Опиумные алкалоиды: Кодеин + Морфин + Носкапин + Папаверина гидрохлорид + Тебаин.
-
Согласно приказу Минздрава России от 20.12.2012 г. N 1175н «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учѐта и хранения» количество выписываемых НС и ПВ списков II и III Перечня, иных лекарственных препаратов, подлежащих предметно-количественному
учѐту, при оказании пациентам, нуждающимся в длительном лечении, первичной медико- санитарной помощи и паллиативной медицинской помощи может быть увеличено не более чем в 2 раза по сравнению с предельно допустимым количеством лекарственных препаратов для выписывания на один рецепт.
В этих случаях на рецептах производится надпись: «По специальному назначению», отдельно скреплѐнная подписью медицинского работника и печатью медицинской организации «Для рецептов».
-
Регистрация операций, связанных с обращением лекарственных средств, являющихся наркотическими средствами, психотропными веществами перечня наркотических средств, психотропных веществ, подлежащих контролю в Российской Федерации, осуществляется субъектами обращения лекарственных средств в специальных журналах по формам, утверждѐнным Постановлением Правительства Российской Федерации от 4 ноября 2006 г. N 644 «О порядке представления сведений о деятельности, связанной с оборотом наркотических средств и психотропных веществ, и регистрации операций, связанных с оборотом наркотических средств и психотропных веществ».
Регистрация операций, связанных с оборотом НС и ПВ, ведѐтся по каждому наименованию НС и ПВ на отдельном развѐрнутом листе журнала регистрации или в отдельном журнале регистрации.
При осуществлении видов деятельности, связанных с оборотом НС и ПВ, любые операции, в результате которых изменяются количество и состояние НС и ПВ, подлежат занесению в журнал регистрации.
Журналы регистрации должны быть сброшюрованы, пронумерованы и скреплены подписью руководителя юридического лица и печатью юридического лица.
Руководитель юридического лица назначает лиц, ответственных за ведение и хранение журналов регистрации, в том числе в подразделениях.
Записи в журналах регистрации производятся лицом, ответственным за их ведение и хранение, шариковой ручкой (чернилами) с периодичностью, устанавливаемой руководителем юридического лица, но не реже одного раза в течение дня совершения операций с НС и ПВ на основании документов, подтверждающих совершение этих операций.
Документы или их копии, подтверждающие совершение операции с НС и ПВ, заверенные в установленном порядке, подшиваются в отдельную папку, которая хранится вместе с соответствующим журналом регистрации.
В журналах регистрации указываются как названия НС и ПВ в соответствии с перечнем, так и иные названия НС и ПВ, под которыми они получены юридическим лицом.
Нумерация записей в журналах регистрации по каждому наименованию НС и ПВ осуществляется в пределах календарного года в порядке возрастания номеров. Нумерация записей в новых журналах регистрации начинается с номера, следующего за последним номером в заполненных журналах.
Не использованные в текущем календарном году страницы журналов регистрации прочѐркиваются и не используются в следующем календарном году.
-
Согласно приказу Минздрава России от 01.08.2012 г. N 54н «Об
утверждении формы бланков рецептов, содержащих назначение наркотических средств или психотропных веществ, порядка их изготовления, распределения, регистрации, учѐта и хранения, а также правил оформления», при первичном выписывании пациенту рецепта на наркотический (психотропный) лекарственный препарат в рамках оказания медицинской помощи при определѐнном заболевании такой рецепт заверяется:
-
подписью и личной печатью врача либо подписью фельдшера (акушерки);
-
подписью руководителя (заместителя руководителя) медицинской организации или руководителя (заместителя руководителя) структурного подразделения медицинской организации либо лицом, уполномоченным руководителем медицинской организации (в случае отсутствия в структурном подразделении медицинской организации должности заведующего (заместителя заведующего) структурным подразделением) (с указанием его фамилии, имени, отчества);
-
печатью медицинской организации либо структурного подразделения медицинской организации «Для рецептов».
-
-
Согласно приказу Минздрава России от 01.08.2012 г. N 54н «Об утверждении формы бланков рецептов, содержащих назначение наркотических средств или психотропных веществ, порядка их изготовления, распределения, регистрации, учѐта и хранения, а также правил оформления» после отпуска НС работник аптеки на рецепте (в правой нижней части рецепта) ставит отметку аптечной организации об отпуске НС, которая заверяется подписью работника аптечной организации, отпустившего НС (с указанием его фамилии, имени, отчества), а также круглой печатью аптечной организации, в оттиске которой должно быть идентифицировано полное наименование аптечной организации.
СИТУАЦИОННАЯ ЗАДАЧА K002392
-
Гипотензивное средство комбинированное (диуретик + АПФ ингибитор); Ингибиторы АПФ в комбинациях.
Показание к применению - эссенциальная гипертензия.
-
Комбинированные лекарственные формы позволяют рационально объединить действие нескольких фармакологически активных веществ (субстанций) в одном направлении.
Комбинации повышают приверженность пациента к лечению (меньшее количество лекарственных средств на один приѐм), позволяют применять меньшие дозы веществ, снижают вероятность проявления побочных эффектов и пр.
Технологические приѐмы: дражжирование, микрокапсулирование, использование соответствующих вспомогательных веществ и др.
-
1. Способ применения и дозы. Начальная доза — по 1 табл. 1 раз в сутки. При необходимости для достижения более выраженного гипотензивного эффекта возможно увеличение дозы препарата до максимальной суточной дозы препарата — 1 табл. (2,5 мг/8 мг) 1 раз в сутки.
-
Взаимодействие с другими веществами. Одновременное применение с препаратами лития не рекомендуется. Одновременное применение ингибиторов АПФ с НПВП (включая ацетилсалициловую кислоту в дозах, оказывающих
противовоспалительное действие, ингибиторы ЦОГ-2 и неселективные НПВП) снижает гипотензивный эффект ингибиторов АПФ, повышает риск развития нарушений функции почек, вплоть до развития острой почечной недостаточности. Трициклические антидепрессанты, антипсихотические средства (нейролептики) усиливают гипотензивный эффект и увеличивают риск развития ортостатической гипотензии.
-
Правила хранения. При температуре не выше 30 °C, в оригинальной упаковке. Хранить в недоступном для детей месте. Срок годности препарата 3 года. Не применять по истечении срока годности, указанного на упаковке.
-
-
Воспроизведенный лекарственный препарат - лекарственный препарат, который имеет такой же качественный состав и количественный состав действующих веществ в такой же лекарственной форме, что и референтный лекарственный препарат, и биоэквивалентность или терапевтическая эквивалентность которого референтному лекарственному препарату подтверждена соответствующими исследованиями.
Референтный лекарственный препарат - лекарственный препарат, который впервые зарегистрирован в Российской Федерации, качество, эффективность и безопасность которого доказаны на основании результатов доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов.
Международное непатентованное наименование лекарственного средства - наименование действующего вещества фармацевтической субстанции, рекомендованное Всемирной организацией здравоохранения.
Торговое наименование лекарственного средства - наименование лекарственного средства, присвоенное его разработчиком, держателем или владельцем регистрационного удостоверения лекарственного препарата.
К оригинальному средству можно отнести «Нолипрел А», воспроизведенные - «Ко- Перинева», «Периндапам», «Периндид».
Аналоги из группы комбинаций: «Enam H», «Enzix», «Энап-Н», «Ко-ренитек»,
«Ирузид» и мн. др.
-
Причины артериальной гипертонии остаются неизвестными в 90% случаев.
Тем не менее, известны определенные факторы, увеличивающие риск развития артериальной гипертензии:
-
возраст (с возрастом стенки крупных артерий становятся более ригидными, а из- за этого повышается сопротивление сосудов кровотоку, следовательно, повышается давление);
-
наследственная предрасположенность;
-
пол (чаще артериальной гипертонией страдают мужчины);
-
курение;
-
чрезмерное употребление алкоголя, соли, ожирение, недостаточная физическая активность;
-
чрезмерная подверженность стрессам;
-
заболевания почек;
-
повышенный уровень адреналина в крови;
-
врождѐнные пороки сердца;
-
регулярный приѐм некоторых лекарственных средств (например, по некоторым
данным регулярный приѐм пероральных контрацептивов);
-
поздние токсикозы беременных (осложнение течения беременности).
Повышение артериального давления может не сопровождаться никакими симптомами и выявляться случайно, при измерении артериального давления. В некоторых случаях возможно появление головной боли, головокружения, мелькания мушек перед глазами.
Осложнения:
-
инсульт;
-
инфаркт;
-
нарушения зрения;
-
сердечная недостаточность;
-
почечная недостаточность. Профилактика артериальной гипертензии.
Если у членов семьи наблюдается артериальная гипертензия (гипертоническая болезнь), или вы старше 30 лет, регулярно измеряйте давление.
Откажитесь от курения, употребления спиртных напитков. Соблюдайте маложирную и малосоленую диету.
Делайте зарядку, желательно на свежем воздухе (езда на велосипеде, бег, активная ходьба).
Старайтесь избегать стрессов, научитесь преодолевать стрессовые ситуации. Поддерживайте нормальный вес тела.
В ходе лечения. После того, как вы добились желаемого эффекта, и давление снизилось, необходимо постоянно контролировать его.
К сожалению, нет каких-либо четких внешних признаков, по которым вы бы могли понять, что давление снова повышается.
Рекомендуют регулярно измерять артериальное давление дома и посещать врача, по крайней мере, раз в год (для контроля общего состояния и эффективности проводимой терапии).
Для контроля АД используют тонометры. Они подразделяются на механические, полуавтоматические и автоматические. Ведущие производители: AND, OMRON, Microlife, B.Well.
СИТУАЦИОННАЯ ЗАДАЧА K002393
-
Выписан сложный дозированный порошок. Содержит вещество списка II – кодеина фосфат.
Приказ Министерства здравоохранения РФ от 20 декабря 2012 г.
N 1175н «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учѐта и хранения».
Используется рецептурный бланк формы N 148-000/у-88. При выписывании рецепта на лекарственный препарат индивидуального изготовления наименования наркотических и психотропных лекарственных препаратов списков II и III Перечня, иных лекарственных препаратов, подлежащих предметно-количественному учѐту, пишутся в начале рецепта,
затем - все остальные ингредиенты.
Состав комбинированного лекарственного препарата, обозначение лекарственной формы и обращение медицинского работника к фармацевтическому работнику об изготовлении и отпуске лекарственного препарата выписываются на латинском языке.
Способ применения лекарственного препарата обозначается с указанием дозы, частоты, времени приѐма относительно сна (утром, на ночь) и его длительности, а для лекарственных препаратов, взаимодействующих с пищей, - времени их употребления относительно приѐма пищи (до еды, во время еды, после еды).
При необходимости немедленного или срочного отпуска лекарственного препарата пациенту в верхней части рецепта проставляются обозначения «cito» (срочно) или «statim» (немедленно).
При выписывании рецепта на лекарственный препарат индивидуального изготовления количество жидких фармацевтических субстанций указывается в миллилитрах, граммах или каплях, а остальных фармацевтических субстанций - в граммах.
Рецепты, выписанные на рецептурном бланке формы N 148-000/у-88, действительны в течение 15 дней со дня выписывания.
-
Проверка доз.
Кодеина фосфат: по рецепту РД = 0,01 СД = 0,03 по ГФ ВРД = 0,1 ВСД = 0,3
Анальгин: по рецепту РД = 0,4 СД = 1,2 по ГФ ВРД = 1,0 ВСД = 3,0
Дозы не завышены. Расчѐты.
Кодеина фосфат: 0,01× 15 = 0,15
Анальгин: 0,4 × 15 = 6,0
Масса общая: 0,15 + 6,0 = 6,15
Развеска: 6,15 / 15 = 0,41 Используем ступку № 4.
Затираем поры ступки Анальгином (так как кодеина фосфат находится на предметно-количественном учѐте).
-
Приказ Минздрава России от 26 октября 2015 г. №751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность».
В ступку № 4 помещаем 6,0 г Анальгина, измельчаем, затирая поры ступки. Выносим его на капсулу. В ступку, с затертыми порами получаем у провизора-технолога, ответственного за хранение веществ, находящихся на предметно-количественном учѐте, по оформленной обратной стороне рецепта, 0,15 г кодеина фосфата. Измельчаем и добавляем в ступку Анальгин с капсулы. Смешиваем. Проверяем однородность порошковой массы, заполняем лицевую сторону ППК и передаем фасовщику для дозирования по 0,41 г в вощеные капсулы и упаковки.
Оформляем этикеткой: «Внутреннее», «Порошки», «Хранить в прохладном месте»,
«Хранить в защищѐнном от света месте», «Беречь от детей». Снабжаем для отпуска сигнатурой.
-
Фармакологическая группа — противокашлевые средства. Опиоидные наркотические анальгетики.
Применение: болевой синдром при травмах, онкологических заболеваниях, почечной и печеночной коликах, приступообразный непродуктивный кашель.
При передозировке: угнетение дыхания, гипотония, тошнота, рвота, атония кишечника и мочевого пузыря, брадикардия, аритмия, аллергические реакции.
Острое отравление требует проведения неотложных мероприятий.
Специфическая (антидотная) терапия является основным методом лечения.
Используется налоксона гидрохлорид - антагонист опиатов.
При подозрении на отравление необходимо:
-
Выяснить, какое вещество и в каком количестве принято, сколько времени прошло с момента приѐма. Диспетчер станции «скорой помощи» попросит вас в первую очередь ответить именно на эти вопросы (до приезда врача обязательно нужно сохранить упаковку от препарата, вызвавшего отравление.)
-
Вызвать «скорую медицинскую помощь».
-
Принять меры по удалению яда из организма.
-
-
Приказ Министерства здравоохранения Российской Федерации от 21.10.1997 г. № 309 «Об утверждении инструкции по санитарному режиму аптечных организаций (аптек)».
Лекарственные вещества, используемые при изготовлении нестерильных лекарственных форм, должны храниться в плотно закрытых штангласах в условиях, исключающих их загрязнение. Штангласы, используемые при хранении лекарственных веществ, перед наполнением моют и стерилизуют.
Вспомогательный материал и укупорочные средства, необходимые при изготовлении и фасовке лекарственных средств, подготавливают, стерилизуют.
Аптечную посуду перед использованием моют, сушат и стерилизуют.
В начале и в конце каждой смены весы, шпатели, ножницы и другой мелкий аптечный инвентарь протирают 3% раствором перекиси водорода или спирт - эфирной смесью (1:1).
После каждого отмеривания или отвешивания лекарственного вещества горловину и пробку штангласа, а также ручные весы вытирают салфеткой из марли. Салфетка употребляется только один раз.
Воронки при фильтрации или процеживании жидких лекарственных средств, а также ступки с порошковой или мазевой массой до развески и выкладывания в тару накрывают пластмассовыми или металлическими пластинками, которые предварительно дезинфицируют.
Для выборки из ступок мазей и порошков используют пластмассовые пластинки.
Применение картона не допускается.
После изготовления мазей остатки жира удаляют при помощи картона, бумаги, лигнина, затем ступки моют и стерилизуют.
Используемые для работы бумажные и вощаные капсулы, шпатели, нитки, резинки
обхваточные и др. хранят в ящиках ассистентского (фасовочного) стола (ящики ежедневно моют).
Вспомогательные материалы хранят в закрытых шкафах в условиях, исключающих их загрязнение.
СИТУАЦИОННАЯ ЗАДАЧА K002490
-
В соответствии с приказом МЗ РФ от 20.12.2012 № 1175н «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учѐта и хранения» указанная рецептурная пропись выписывается на бланке формы 107-000/у.
На рецептурном бланке ставится штамп медицинской организации с указанием еѐ наименования, адреса и телефона, дата выписки, ФИО пациента и медицинского работника указывается полностью, в графе возраст указывается количество полных лет.
В графе «Rp» указывается: на латинском языке наименование фармацевтических субстанций, количество; на русском или русском и национальном языках способ применения лекарственного препарата.
Рецепт, подписывается медицинским работником и заверяется его личной печатью.
-
В соответствии с приказом МЗ РФ от 26.10.2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность» и приказом МЗ РФ от 19.07.1997 г. № 214 «О контроле качества лекарственных средств, изготовляемых в аптечных организациях (аптеках)» паспорт письменного контроля сохраняются в аптеке в течение двух месяцев с момента изготовления лекарственного средства.
-
Создание асептических условий в аптеке
В аптеке изготовление лекарственных форм в условиях асептики осуществляется в соответствии с санитарными требованиями, изложенными в приказе МЗ РФ № 309 от 21.10.1997 г. и методических указаниях по изготовлению стерильных растворов в аптеках, утверждѐнных МЗ РФ 24.08.1994 г.
Для изготовления глазных и других стерильных лекарственных форм в асептических условиях в аптеке оборудуется асептический блок, который включает помещения для изготовления, фасовки и стерилизации, а также получения воды для инъекций и отделен от других помещений аптеки шлюзом.
Асептика – это комплекс мероприятий, позволяющий свести к минимуму возможность попадания микроорганизмов в лекарственные препараты на всех этапах технологического процесса.
При этом исходят из того, что основными источниками загрязнения лекарственных препаратов являются:
-
помещения,
-
технологическое оборудование,
-
воздух,
-
обслуживающий персонал,
-
вспомогательный материал,
-
посуда,
-
лекарственные и вспомогательные вещества, растворители.
В помещении для приготовления лекарственных препаратов в асептических условиях стены должны быть покрашены масляной белой краской или покрыты светлой кафельной плиткой. Не должно быть карнизов, выступов, трещин.
Пол покрывается линолеумом с заваренными швами. Двери и окна должны быть тщательно подогнаны и не иметь щелей.
Асептический блок оборудуется приточно-вытяжной вентиляцией с преимуществом приточного воздуха. Для снижения попадания микроорганизмов рекомендуется установка фильтров для очистки воздуха и ультрафиолетовое облучение.
Для обезвреживания воздуха в асептическом блоке устанавливают неэкранированные бактерицидные лампы: настенные (ОБН-150), бактерицидные лампы БУВ – 25, БУВ-30, БУВ - 60 из расчѐта мощности 2-2,5 Вт на 1м3 объѐма помещения, которую включают на 1-2 часа перед началом работы при отсутствии людей. Перед входом в асептический блок на этот период вешают табличку «не входить, включена бактерицидная лампа».
Вход в помещение, где включена неэкранированная бактерицидная лампа, разрешается только после еѐ отключения, а длительное пребывание в указанном помещении – только через 15 минут после еѐ отключения.
В присутствии персонала могут эксплуатироваться экранированные бактерицидные лампы, которые устанавливаются на высоте 1,8 - 2 м с мощностью в 1 Вт на 1м3 помещения при условии, что излучение не направлено на людей, которые находятся в помещении.
Поскольку при работе бактерицидной лампы образуются окислы азота и озон, то в помещении необходима работа вентиляции.
Все оборудование и мебель которые вносятся в асептический блок, предварительно протирают влажной тряпкой смоченной дезинфицирующим раствором (например, раствор хлорамина Б 1 %, раствор хлорамина Б 0,75 % с 0,5 % моющего средства, раствор перекиси водорода 3 % с 0,5% моющего средства и др.). Использование в асептическом блоке постороннего оборудования строго запрещено. Уборка помещения проводится не реже одного раза за смену с использованием дезинфицирующих средств с последующим ультрафиолетовым облучением.
Один раз в неделю в помещении проводят генеральную уборку.
Перед входом в асептический блок должен лежать резиновый коврик, смоченный дезинфицирующим раствором.
Асептический блок отделяется от других помещений шлюзом.
Лица, которые принимают участие в приготовлении лекарств в асептических условиях, придерживаются строгих правил личной гигиены: при входе в шлюз одевают специальную обувь, моют руки с мылом и щеткой, потом дезинфицируют их, протирая салфеткой, смоченной этиловым спиртом 80 % концентрации, раствором хлоргексидина биглюконата в 70 % спирте этиловом или 0,5 % раствор хлорамина Б при отсутствии вышеперечисленных средств, одевают стерильный халат, 4-слойную марлевую повязку,
шапочку (при этом волосы тщательно заправляют), бахилы. Марлевая повязка должна заменяться через каждые 4 часа.
Санитарную одежду, халаты, марлю, изделия из текстиля, вата стерилизуются в биксах в паровых стерилизаторах при температуре 132 ºС на протяжении 20 минут или при 120 ºС на протяжении 45 минут и хранят в закрытых биксах не более 3 суток. Обувь перед началом и окончанием работы дезинфицируют внешне и хранят в шлюзах.
Создание асептических условий в аптеке предполагает также использование стерильного вспомогательного материала, средств укупорки и упаковки, стерилизацию вспомогательных и лекарственных средств, если они могут быть простерилизованы.
-
-
В соответствии с приказом МЗ РФ от 26.10.2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность» приѐмочный контроль заключается в проверке поступающих лекарственных средств на соответствие требованиям по показателям:
«Описание», «Упаковка», «Маркировка», а также в проверке правильности оформления сопроводительных документов, включая документы, подтверждающие качество лекарственных средств.
-
Действующими веществами в составе изготовленных глазных капель являются рибофлавин (препарат витамина В2) и кислота аскорбиновая (препарат витамина С). Основная цель применения «витаминных» глазных капель – нормализация обмена веществ роговицы (наружной оболочки глазного яблока) и внутренних сред глаза, прежде всего – хрусталика. Показаниями к применению изготовленного лекарственного препарата являются
а) предупреждение нарушения оптических свойств роговицы и хрусталика глаза в процессе старения, а также при соматических заболеваниях, сопровождающихся грубыми нарушениями системного метаболизма, например, при сахарном диабете/метаболическом синдроме;
б) коррекция уже состоявшихся нарушений оптических свойств роговицы и хрусталика при катаракте.
СИТУАЦИОННАЯ ЗАДАЧА K002491
-
В соответствии с приказом МЗ РФ от 20.12.2012 г. № 1175н «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учѐта и хранения» указанная рецептурная пропись выписывается на бланке формы 107-000/у. На рецептурном бланке ставится штамп медицинской организации с указанием еѐ наименования, адреса и телефона, дата выписки, ФИО пациента и медицинского работника указывается полностью, в графе возраст указывается количество полных лет.
В графе «Rp» указывается: на латинском языке наименование фармацевтических субстанций, количество; на русском или русском и национальном языках способ применения лекарственного препарата. Рецепт, подписывается медицинским работником и заверяется его личной печатью.
-
В соответствии с приказом МЗ РФ от 26.10.2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность» продолжительность хранения глазной мази не более 10 суток.
-
Прописанная мазь по дисперсологической классификации является свободной всесторонне дисперсной системой с упруго-вязкой дисперсионной средой, гетерогенной эмульсионной мазью.
Мазь приготовлена неверно. В данном случае в асептических условиях готовят мазь эмульсионного типа, поскольку сульфацил-натрия растворим в воде, но не суспензию, как поступил фармацевт. Растворение лекарственного вещества в воде обеспечивает его максимальное диспергирование до ионного и молекулярного состояния, что в свою очередь способствует более быстрому и сильному терапевтическому действию мази.
В асептических условиях в 1 мл воды очищенной стерильной растворяют 1,8 сульфацила-натрия и тщательно эмульгируют в стерильной ступке стерильным сплавом ланолина безводного и вазелина сорта «Для глазных мазей» до полного его поглощения, после чего смешивают со стерильным вазелиновым маслом, смешивают до однородности. Помещают в стерильную широкогорлую склянку с полиэтиленовой стерильной крышкой.
Отпускают с этикетками «Наружное», «Глазная мазь», предупредительной этикеткой: «Хранить в прохладном, защищѐнном от света месте», «Хранить в недоступном для детей месте», «Приготовлено в асептических условиях».
Так как в состав мази входят гидрофобные вещества вазелин и масло вазелиновое, а также эмульгатор ланолин безводный – при смешивании этих компонентов образуется дифильная абсорбционная основа, хорошо смешивающаяся с водным раствором сульфацила–натрия с образованием мази эмульсионного типа вода/масло.
При смешивании водного раствора лекарственного вещества с основой образуется эмульсионная система, которая подчиняется общим законам, управляющим поведением эмульсий. Для образования стабильной эмульсионной системы применяется эмульгатор – ланолин безводный, который располагается на межфазной поверхности и понижает запас свободной поверхностной энергии частиц, образуя устойчивую систему.
-
В соответствии с приказом МЗ РФ от 26.10.2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность» контролю при отпуске лекарственных препаратов подвергаются все изготовленные лекарственные препараты, в рамках которого проверяется соответствие:
а) упаковки лекарственного препарата физико-химическим свойствам, входящих в него лекарственных средств;
б) указанных в рецепте или требовании доз наркотических средств, психотропных, сильнодействующих веществ возрасту пациента;
в) реквизитов рецепта, требования сведениям, указанным на упаковке изготовленного лекарственного препарата;
г) маркировки лекарственного препарата требованиям.
При выявлении одного из указанных несоответствий изготовленный лекарственный препарат не подлежит отпуску.
-
Основная цель применения изготовленного лекарственного препарата – местное антибактериальное (антисептическое) воздействие на патогенную флору, паразитирующую в конъюнктивальной полости, отчасти – носо-слѐзном канале. Антисептический эффект изготовленной глазной мази обеспечивается сульфацилом- натрия в еѐ составе. Сульфацил-натрия – синтетическое антибактериальное средство группы сульфаниламидов с умеренной выраженностью антибактериальной активности. Основным показанием к применению изготовленного лекарства является бактериальный (гнойный) конъюнктивит.
СИТУАЦИОННАЯ ЗАДАЧА K002492
-
В соответствии с приказом МЗ РФ от 20.12.2012 г. № 1175н «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учѐта и хранения» указанная рецептурная пропись выписывается на бланке формы 107-000/у. На рецептурном бланке ставится штамп медицинской организации с указанием еѐ наименования, адреса и телефона, дата выписки, ФИО пациента и медицинского работника указывается полностью, в графе возраст указывается количество полных лет.
В графе «Rp» указывается:
на латинском языке наименование фармацевтических субстанций, количество; на русском или русском и национальном языках способ применения лекарственного препарата. Рецепт, подписывается медицинским работником и заверяется его личной печатью.
-
Рецепты на лекарственные препараты, выписанные на рецептурных бланках формы № 107-000/у, действительны в течение 60 дней со дня выписывания.
Рецептурный бланк формы № 107-000/у не хранится в аптеке.
-
Данная микстура изготовлена неудовлетворительно. Допущена ошибка при расчѐте количества воды, так как Кв. травы пустырника = 2,0 мл/г, следовательно, воды необходимо взять 240 мл. Кроме того, до стадии настаивания необходимо фарфоровый инфундирный стакан подогреть. После растворения лекарственных веществ в настое микстуру необходимо фильтровать в мерный цилиндр и при необходимости довести водой очищенной до 200 мл. Затем микстуру перелить в отпускной флакон тѐмного стекла, после чего добавить в последнюю очередь 6 мл настойки валерианы. При оформлении следует добавить предупредительную надпись «Хранить в прохладном месте» и «Хранить в защищѐнном от света месте», «Хранить в недоступном для детей месте».
-
В соответствии с приказом МЗ РФ от 26.10.2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность» приѐмочный контроль заключается в проверке
поступающих лекарственных средств на соответствие требованиям по показателям:
«Описание», «Упаковка», «Маркировка», а также в проверке правильности оформления сопроводительных документов, включая документы, подтверждающие качество лекарственных средств.
-
Входящие в состав выписанной микстуры ингредиенты обеспечивают выраженный седативный/успокаивающий и анальгетический/обезболивающий эффекты. Добиться аналогичного фармакотерапевтического действия можно сочетанием готовых лекарственных препаратов, разрешѐнных к отпуску в аптеке без рецепта врача. Например, Броменвал + Метамизол; Магне-В6 (или аналоги) + Метамизол и пр.
СИТУАЦИОННАЯ ЗАДАЧА K002495
-
В соответствии с приказом МЗ РФ от 20.12.2012 г. № 1175н этиловый спирт (подлежит предметно-количественному учѐту в соответствии с приказом МЗ РФ от 22.04.2014 г. № 183н) выписывается на рецептурном бланке формы N 148-000/у-88, который должен иметь номер и серию.
На бланке ставится штамп медицинской организации с указанием адреса и телефона, дата выписки, ФИО пациента и медицинского работника указывается полностью, в графе возраст указывается количество полных лет, в графе «Адрес или номер медицинской карты пациента, получающего медицинскую помощь в амбулаторных условиях» указывается полный почтовый адрес места жительства (места пребывания или места фактического проживания) пациента или номер медицинской карты пациента, получающего медицинскую помощь в амбулаторных условиях.
В графе «Rp» указывается: на латинском языке наименование ЛП (международное непатентованное или группировочное, либо торговое), его дозировка, количество; на русском или русском и национальном языках способ применения лекарственного препарата.
Рецепт, подписывается медицинским работником и заверяется его личной печатью.
Дополнительно заверяется печатью медицинской организации «Для рецептов».
-
Спирт этиловый подлежит предметно-количественному учѐту (приказ МЗ РФ от 22.04.2014 г. № 183н) в Журнале учѐта операций, связанных с обращением лекарственных средств для медицинского применения. В соответствии с приказом МЗ РФ от № 17.06.2013 г. № 378н журнал учѐта должен быть сброшюрован, пронумерован и скреплѐн подписью руководителя юридического лица и печатью юридического лица. Записи в журнале учѐта производятся лицом, ответственным за их ведение и хранение, шариковой ручкой (чернилами) в конце рабочего дня на основании документов, подтверждающих совершение этих операций (в данном случае – рецепта). Документы или их копии, заверенные в установленном порядке, подшиваются в отдельную папку, которая хранится вместе с соответствующим журналом учѐта. Исправления в журналах регистрации заверяются подписью лица, ответственного за их ведение и хранение. Подчистки и незаверенные исправления в журналах регистрации не допускаются. На последнее число каждого месяца лицо, уполномоченное на ведение и хранение журналов учѐта, проводит сверку фактического наличия лекарственных средств с их остатком по журналу учѐта и вносит соответствующие записи в журнал учѐта. Журнал хранится в
металлическом шкафу (сейфе), ключи от которого находятся у лица, уполномоченного на ведение и хранение журнала учѐта.
-
Выписана суспензия – жидкая лекарственная форма, представляющая собой гетерогенную дисперсную систему, содержащую одно или несколько твѐрдых действующих веществ, распределѐнных в жидкой дисперсионной среде. Данная суспензия состоит из дисперсионной среды (воды, глицерина, спирта) и дисперсной фазы (частиц твѐрдых ЛВ, практически нерастворимых в данной жидкости).
Суспензии готовят двумя способами: дисперсионным и конденсационным. Данная суспензия из гидрофильных веществ должна быть приготовлена дисперсионным методом путѐм простого диспергирования без стабилизатора, так как входящие в состав тальк, цинка оксид и крахмал являются гидрофильными ненабухающими. В суспензиях из гидрофильных веществ на поверхности частиц образуется гидратный слой, обеспечивающий устойчивость системы (закон Стокса, указывающий на возможность изменения факторов, повышающих устойчивость системы).
Измельчение проводят с использованием правила Дерягина, на основании которого к измельчѐнным веществам (по правилам приготовления порошков) добавляют дисперсионную среду (глицерин) около ½ от массы веществ дисперсной фазы с целью обеспечения расклинивающего действия, перемешивают пестиком, получая тонкую пульпу. Затем к пульпе добавляют оставшееся количество глицерина, а затем разбавляют водой в 2-3 приѐма, аккуратно перенося в отпускной флакон прозрачного стекла. В последнюю очередь к готовой суспензии во флакон добавляют 5 мл 90% спирта. Укупоривают пробкой и навинчивающейся крышкой, встряхивают и оформляют к отпуску.
-
В соответствии с приказом МЗ РФ от 22.04.2014 г. № 183н «Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно- количественному учѐту» спирт этиловый подлежит предметно-количественному учѐту. Норма отпуска этилового спирта установлена в приказе МЗСР РФ от 14.12.2005 г. № 785
«О порядке отпуска лекарственных средств»:
-
по рецептам, выписанным врачами с надписью: «Для наложения компрессов» (с указанием необходимого разведения водой) или «Для обработки кожи» – до 50 граммов в чистом виде;
-
по рецептам, выписанным врачами на лекарственную пропись индивидуального изготовления – до 50 граммов в смеси;
-
по рецептам, выписанным врачами на лекарственную пропись индивидуального изготовления с надписью «По специальному назначению», отдельно заверенной подписью врача и печатью медицинской организации «Для рецептов», для больных с хроническим течением болезни – до 100 граммов в смеси и в чистом виде.
-
-
Основной эффект талька и цинка оксида – адсорбирующий или
«подсушивающий». Реализуется уменьшением влажности кожи, мокнутия, объѐма патологического (например, раневого) отделяемого. Спирт этиловый обладает антисептическим и вяжущим эффектами, уменьшая выделение пота и предотвращая размножение бактериальной флоры и появление неприятного запаха. Таким образом, изготовленное лекарственное средство будет применено по поводу гипергидроза
(повышенной влажности) стоп с целью уменьшения потоотделения.
СИТУАЦИОННАЯ ЗАДАЧА K002496
-
Согласно пункту 11 утверждѐнного приказом МЗ РФ от 20.12.2012 г. № 1175н «Порядка назначения и выписывания лекарственных препаратов» рецептурный бланк формы № 107-000/у предназначен для выписывания лекарственных препаратов, указанных в пункте 4 «Порядка отпуска физическим лицам лекарственных препаратов для медицинского применения, содержащих, кроме малых количеств наркотических средств, психотропных веществ и их прекурсоров, другие фармакологические активные вещества», утверждѐнного приказом Министерства здравоохранения Российской Федерации от 17 мая 2012 года № 562н.
Согласно приказу МЗ и СР РФ от 17 мая 2012 г. № 562н «Об утверждении Порядка отпуска физическим лицам лекарственных препаратов для медицинского применения, содержащих кроме малых количеств наркотических средств, психотропных веществ и их прекурсоров другие фармакологические активные вещества» отпуску по рецептам, выписанным на рецептурных бланках формы № 107-000/у, подлежат комбинированные лекарственные препараты, содержащие: фенобарбитал в количестве до 20 мг включительно в сочетании с эрготамином гидротартратом независимо от количества (на 1 дозу твѐрдой лекарственной формы).
Таким образом, данный комбинированный препарат (торговое наименование Беллатаминал) отпускается по рецепту, выписанному на бланке 107-000/у, оформленному в установленном порядке.
Препарат не подлежит предметно-количественному учѐту, но за отпуск его без рецепта предусмотрена уголовная ответственность.
В соответствии с приказом МЗ РФ от 20.12.2012 г. № 1175н реквизитами рецептурного бланка являются штамп медицинской организации с указанием наименования, адреса и телефона, дата выписки рецепта, ФИО медицинского работника (полностью), ФИО пациента (полностью), возраст пациента (количество полных лет), наименование ЛП на латинском языке по МНН или группировочному наименованию, а в случае их отсутствия по торговому наименованию, дозировка, количество, способ применения ЛП, подпись и личная печать медицинского работника.
При отпуске ЛП делается отметка на рецепте, содержащая наименование или номер аптечной организации, наименование и дозировку ЛП, отпущенное количество, дата отпуска, подпись работника аптечной организации, отпустившего ЛП.
-
Срок действия рецепта - 60 дней. Рецепт не хранится в аптечной организации и возвращается на руки пациенту.
-
Фенобарбитал является производным барбитуровой кислоты (барбитураты).
Барбитураты обладают седативным, снотворным и противосудорожным (противоэпилептическим) свойствами.
В больших дозах они вызывают состояние наркоза, поэтому некоторые барбитураты короткого действия применяют для неингаляционного наркоза.
В меньших дозах барбитураты оказывают выраженное снотворное действие, способствуют засыпанию и увеличивают общую продолжительность сна.
дозах.
Седативный эффект (без снотворного) барбитураты оказывают ещѐ в меньших
-
Фармакологическая группа: утеротоники и альфа-адреноблокаторы. Алкалоиды спорыньи вызывают стойкое тоническое сокращение миометрия,
используются для остановки маточных кровотечений и для инволюции матки после родов.
Кровоостанавливающее действие вызывается механическим сжатием стенок сосудов при сокращении миометрия.
Для ускорения родовой деятельности алкалоиды спорыньи не применяют, поскольку спазм миометрия может вызвать асфиксию плода.
Кроме того, эрготамин уменьшает пульсовые колебания сосудов головного мозга и применяется для лечения мигрени.
-
Препараты красавки (белладонны) содержат атропин. Главным алкалоидом этих растений является L-гиосциамин, который при выделении превращается в рацемическую смесь L- и D-гиосциамина - атропин.
Для отравления атропином характерны: расширенные зрачки и ухудшение зрения, фотофобия (светобоязнь), сухость слизистых оболочек полости рта, носоглотки, что может привести к нарушению глотания и речи, сухость и покраснение кожи и повышение температуры тела (вследствие нарушения потоотделения и теплоотдачи), тахикардия, головная боль, головокружение, задержка мочеиспускания.
В тяжѐлых случаях возникают зрительные и слуховые галлюцинации, бред, возможны судороги, которые сменяются состоянием угнетения и комой. Смерть наступает от паралича дыхательного центра.
Для устранения эффектов атропина парентерально вводят антихолинэстеразные средства, проникающие в ЦНС. Другие меры при отравлении атропином состоят в промывании желудка и назначении солевых слабительных, энтеросорбентов (Активированный уголь), танина (можно крепкий чай); для удаления вещества из крови используют гемосорбцию, форсированный диурез. При сильном возбуждении применяют Диазепам или барбитураты короткого действия. При необходимости - искусственное дыхание.
СИТУАЦИОННАЯ ЗАДАЧА K002497
-
Фармакологическая группа: НПВС – производные пропионовой кислоты в комбинациях, пиразолоны в комбинациях.
Фармакологическое действие препарата Пенталгин-Н: противовоспалительное, жаропонижающее, анальгезирующее, спазмолитическое, седативное.
Обладает свойствами седативных средств (Фенобарбитал), ненаркотических анальгетиков и НПВС (Метамизол, Напроксен), усиленными Кодеином (блокирует опиатные рецепторы) и Кофеином (увеличивает проницаемость гистогематических барьеров).
Показания препарата Пенталгин-Н: мигрень, умеренно выраженный болевой синдром: боль зубная и головная, миалгия, артралгия, радикулит, невралгия, альгодисменорея, лихорадочные состояния, простудные заболевания, сопровождающиеся болью и воспалительными явлениями.
-
Метамизол натрия, Напроксен.
-
Согласно приказу МЗ РФ от 22.04.2014 г. № 183н «Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно- количественному учѐту» и в соответствии с положениями приказа МЗ и СР РФ от 17.05.2012 г. № 562н «Об утверждении Порядка отпуска физическим лицам лекарственных препаратов для медицинского применения, содержащих кроме малых количеств наркотических средств, психотропных веществ и их прекурсоров другие фармакологические активные вещества», Пенталгин-Н отпускается по рецепту, выписанному на рецептурном бланке формы № 148-000/у-88.
Выдержка из приказа № 562н:
-
отпуску по рецептам, выписанным на рецептурных бланках формы № 148-000/у-88, подлежат комбинированные лекарственные препараты, содержащие: Кодеин или его соли (в пересчѐте на чистое вещество) в количестве до 20 мг включительно (на 1 дозу твѐрдой лекарственной формы) или в количестве до 200 мг включительно (на 100 мл или 100 г жидкой лекарственной формы для внутреннего применения).
В соответствии с приказом МЗ РФ от 20.12.2012 г. № 1175н «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учѐта и хранения»: рецептурный бланк должен быть заполнен разборчиво, чѐтко, шариковой ручкой, без исправлений.
В верхнем левом углу должен быть проставлен штамп МО с указанием полного наименования МО, еѐ адреса и телефона.
Должны быть: серия и номер рецепта, дата выписки.
Полностью должны быть указаны ФИО пациента, возраст больного.
В графе «ФИО врача» должно быть полностью указано ФИО врача, выписавшего рецепт.
В строке «Rp:» на латинском языке должны быть указаны МНН компонентов препарата, дозировки, количество и способ приѐма.
В данном случае, кроме несоответствия ФИО врача, также было нарушение при выписывании названия (выписано по торговому наименованию, а не по МНН).
Рецепт заверяется подписью и личной печатью врача, а также печатью МО «Для рецептов».
Срок действия рецепта – 15 дней.
При отпуске препарата необходимо проверить соответствие количества выписанного препарата предельно допустимому количеству: в приложении 1 к приказу № 1175н указано предельное предельно допустимое количество ЛП для выписывания на один рецепт в пересчѐте на кодеин основание = 0,2 г.
-
-
Согласно приказу МЗ РФ от 22.04.2014 г. № 183н «Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно- количественному учѐту», Пенталгин-Н подлежит предметно-количественному учѐту.
Выдержка из приказа № 183н: предметно-количественному учѐту подлежат комбинированные лекарственные препараты, содержащие кроме малых количеств наркотических средств, психотропных веществ и их прекурсоров другие
фармакологические активные вещества (Пункт 5 Порядка отпуска физическим лицам лекарственных препаратов для медицинского применения, содержащих кроме малых количеств наркотических средств, психотропных веществ и их прекурсоров другие фармакологические активные вещества, утверждѐнного приказом Министерства здравоохранения и социального развития Российской Федерации от 17 мая 2012 г. № 562н):
1) кодеин или его соли (в пересчѐте на чистое вещество) в количестве до 20 мг включительно (на 1 дозу твѐрдой лекарственной формы) или в количестве до 200 мг включительно (на 100 мл или 100 г жидкой лекарственной формы для внутреннего применения).
Учѐт ведѐтся в Журнале учѐта операций, связанных с обращением лекарственных средств для медицинского применения (приказ Минздрава РФ от 17.06.2013 г. № 378н
«Об утверждении правил регистрации операций, связанных с обращением лекарственных средств для медицинского применения, включѐнных в перечень лекарственных средств для медицинского применения, подлежащих предметно-количественному учѐту, в специальных журналах учѐта операций, связанных с обращением лекарственных средств для медицинского применения, и правил ведения и хранения специальных журналов учѐта операций, связанных с обращением лекарственных средств для медицинского применения»).
Выдержка из приказа № 378н.
Регистрация операций, связанных с обращением лекарственных средств, ведѐтся по каждому торговому наименованию лекарственного средства (для каждой отдельной дозировки и лекарственной формы) на отдельном развѐрнутом листе журнала учѐта или в отдельном журнале учѐта на бумажном носителе или в электронном виде.
Регистрация операций осуществляется лицами, уполномоченными руководителем юридического лица на ведение и хранение журналов учѐта, или индивидуальным предпринимателем, имеющим лицензию на фармацевтическую деятельность.
Журналы учѐта, заполняемые на бумажном носителе, сброшюровываются, пронумеровываются и скрепляются подписью руководителя юридического лица (индивидуального предпринимателя) и печатью юридического лица (индивидуального предпринимателя) перед началом их ведения.
Журналы учѐта оформляются на календарный год.
Листы журналов учѐта, заполняемых в электронной форме, ежемесячно распечатываются, нумеруются, подписываются лицом, уполномоченным на ведение и хранение журналов учѐта, и брошюруются по наименованиям лекарственного средства, дозировке, лекарственной форме.
По истечении календарного года сброшюрованные листы оформляются в журнал, опечатываются с указанием количества листов и заверяются подписью лица, уполномоченного на ведение и хранение журналов учѐта, руководителя юридического лица (индивидуального предпринимателя) и печатью юридического лица (индивидуального предпринимателя).
Записи в журналах учѐта производятся лицом, уполномоченным на ведение и хранение журнала учѐта, шариковой ручкой (чернилами) в конце рабочего дня на
основании документов, подтверждающих совершение приходных и расходных операций с лекарственным средством.
Поступление лекарственного средства отражается в журнале учѐта по каждому приходному документу в отдельности с указанием номера и даты. Расход лекарственного средства записывается ежедневно. Аптечные организации и индивидуальные предприниматели, имеющие лицензии на фармацевтическую деятельность, записывают ежедневный расход лекарственного средства с указанием отдельно по рецептам, выписанным медицинским работникам, и по требованиям медицинских организаций.
Исправления в журналах учѐта заверяются подписью лица, уполномоченного на ведение и хранение журналов учѐта. Подчистки и незаверенные исправления в журналах учѐта не допускаются.
На последнее число каждого месяца лицо, уполномоченное на ведение и хранение журналов учѐта, проводит сверку фактического наличия лекарственных средств с их остатком по журналу учѐта и вносит соответствующие записи в журнал учѐта.
Журнал учѐта хранится в металлическом шкафу (сейфе), ключи от которого находятся у лица, уполномоченного на ведение и хранение журнала учѐта. Приходные и расходные документы (их копии) подшиваются в порядке их поступления по датам и хранятся вместе с журналом учѐта.
Заполненные журналы учѐта хранятся в архиве юридического лица (индивидуального предпринимателя).
-
Срок действия рецептурного бланка 148 -000/у-88 – 15 дней.
Рецептурный бланк остаѐтся в аптеке и хранится 3 года (Приказ Министерства здравоохранения и социального развития РФ от 14 декабря 2005 г. № 785 «О порядке отпуска лекарственных средств»).
СИТУАЦИОННАЯ ЗАДАЧА K002498
-
«Флемоксин Солютаб» отпускается по рецепту врача, но не подлежит предметно-количественному учѐту (согласно приказу МЗ РФ от 22.04.2014 г. № 183н «Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно-количественному учѐту»).
В соответствии с приказом Минздрава России от 20.12.2012 г. № 1175н (ред. от 21.04.2016 г.) «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учѐта и хранения» данный препарат должен выписываться на рецептурном бланке формы № 107-000/у.
Допускается оформление всех реквизитов рецептурных бланков формы № 107-000/у с использованием компьютерных технологий.
В верхнем левом углу проставляется штамп МО с указанием полного наименования МО, еѐ адреса и телефона. Проставляется отметка категории больного.
Должны быть: дата выписки рецепта, полностью указаны ФИО пациента, возраст больного.
В графе «ФИО врача» должны быть полностью указаны ФИО врача, выписавшего рецепт.
В строке «Rp:» на латинском языке указывается международное непатентованное наименование препарата (Амоксициллин), дозировка, количество и способ приѐма.
Рецепт заверяется подписью и личной печатью.
-
Срок действия рецептурного бланка – 60 дней. При отпуске на обороте рецептурного бланка ставится отметка аптечной организации об отпуске ЛП, рецептурный бланк не остаѐтся в аптечной организации и не хранится.
-
МНН – Амоксициллин.
Препарат назначают до, во время или после приѐма пищи. Таблетку можно проглотить целиком, разделить на части или разжевать, запив стаканом воды, а также можно развести в воде с образованием сиропа (в 20 мл) или суспензии (в 100 мл), обладающих приятным фруктовым вкусом.
При курсовом лечении необходимо проводить контроль за состоянием функции органов кроветворения, печени и почек.
Лечение обязательно продолжается еще 48–72 часов после исчезновения клинических признаков заболевания.
Появление тяжѐлой диареи, характерной для псевдомембранозного колита, является показанием для отмены препарата.
Возможно развитие суперинфекции за счѐт роста нечувствительной к препарату микрофлоры, что требует соответствующего изменения антибактериальной терапии.
Возможна перекрѐстная устойчивость с препаратами пенициллинового ряда и цефалоспоринами.
Назначать препарат больным с инфекционным мононуклеозом и лимфолейкозом нужно с осторожностью, так как высока вероятность появления экзантемы неаллергического генеза.
При одновременном применении эстрогенсодержащих пероральных контрацептивов и Амоксициллина следует по возможности использовать другие или дополнительные методы контрацепции.
-
Фармакологическая группа: антибиотики – пенициллины.
Показания – инфекционно-воспалительные заболевания, вызванные чувствительными к Амоксициллину микроорганизмами:
-
инфекции органов дыхания;
-
инфекции органов мочеполовой системы;
-
инфекции органов желудочно-кишечного тракта;
-
инфекции кожи и мягких тканей.
-
-
Необходимо рекомендовать посещение участкового врача-терапевта во избежание осложнений ангины: ревматизм, миокардит, инфекционный полиартрит, пиелонефрит, паратонзиллярный абсцесс, острый гнойный лимфаденит, флегмона шеи, сепсис, менингит.
Можно предложить препараты для местного применения из группы антисептики и дезинфицирующие средства в комбинациях, например, гексетидин (Гексорал), мяты перечной листьев масло + месульфамид + сульфатиазол + тимол + эвкалиптовое масло (Ингалипт), бензокаин + цетилпиридиния хлорид (Септолете® плюс), тетракаин + хлоргексидин (Анти-Ангин® Формула).
СИТУАЦИОННАЯ ЗАДАЧА K002499
-
Распоряжением Правительства РФ № 2885-р от 28 декабря 2016 г. утверждѐн перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) на 2017 год.
Перечень ЖНВЛП на 2017 год аналогичен перечню на 2016 год.
«Витрум Бьюти Элит» не входит в указанный перечень, в соответствии с этим для препарата могут не устанавливаться предельные розничные надбавки (в зависимости от региона).
-
Витрум Бьюти Элит относится к препаратам «для улучшения качества жизни».
Данные товары в большинстве случаев приобретаются относительно платежеспособными потребителями, и ценовая чувствительность значительно ниже, разница в цене примерно ±15% зачастую не имеет при выборе аптеки существенного значения.
Большая разница в цене может иметь значение для покупателей.
Поэтому в данном случае необходимо выбрать стратегию ценообразования, ориентированную на конкурентов, то есть снизить цену, чтобы незначительно отличалась от цен конкурентов.
-
Фармакологическая группа: витамины.
Профилактика и лечение гиповитаминозов и авитаминозов, недостатка минеральных веществ в организме при повышенных физических и умственных нагрузках, в период восстановления после инфекционных заболеваний, несбалансированное и неполноценное питание.
-
Препараты витамина А: Ретинола ацетат, Ретинола пальмитат, Каротин, Веторон, Бетакаротен.
Витамин А участвует в окислительно-восстановительных реакциях в организме, необходим для образования зрительного пурпура родопсина, который входит в состав фоторецепторов, обеспечивающих сумеречное зрение. Оказывает влияние на обмен липидов, участвует в синтезе гликопротеинов и гликозаминогликанов, что необходимо для нормального функционирования эпителия кожи и слизистых оболочек. При дефиците витамина А развивается гемералопия, поражаются кожные покровы и слизистые оболочки, уменьшается содержание лизоцима в сыворотке крови и других жидкостях, понижается активность лейкоцитов.
Препараты витамина D: Эргокальциферол, Холекальциферол, Кальциферол, Кальцитриол.
Витамин D участвует в обмене кальция и фосфора, способствуя их всасыванию в кишечнике и реабсорбции в почечных канальцах.
Препараты витамина Е: Токоферола ацетат.
Наибольшей биологической активностью обладает α-токоферол, который необходим для нормального функционирования мембран эритроцитов, миокарда, скелетных мышц. Антиоксидантные свойства витамина Е обусловлены его способностью инактивировать свободные радикалы и, тем самым, тормозить перекисное окисление липидов. Дефицит витамина Е вызывает нарушение половой функции, дистрофию
миокарда, скелетных мышц. Снижается проницаемость мембран для ионов кальция.
Препараты витамина К: Фитоменадион (витамин К), Менадиона натрия бисульфит (Викасол).
Витамин К синтезируется микрофлорой кишечника (витамин К2), а также поступает с растительной пищей. Биологическая роль определяется участием в процессах свѐртывания крови. Необходим для синтеза в печени протромбина (фактора II), других белков, принимающих участие в свѐртывании крови (факторов VII, IX, X, белка С), и белка костной ткани остеокальцина, которые обладают способностью связывать кальций.
-
Гиперчувствительность к компонентам препарата, беременность, период грудного вскармливания, детский возраст до 18 лет.
Не рекомендуется принимать препарат лицам с повышенным риском развития тромбозов (после операций на сердце, сосудах, аортокоронарного шунтирования).
СИТУАЦИОННАЯ ЗАДАЧА K002501
-
В соответствии с приказом Минздрава РФ № 646н от 31.08.2016 г. «Правила надлежащей практики хранения и перевозки лекарственных препаратов» руководителем субъекта обращения лекарственных препаратов с учѐтом требований трудового законодательства РФ и иных нормативных правовых актов, содержащих нормы трудового права, назначается лицо, ответственное за внедрение и обеспечение системы качества, осуществляющее мониторинг эффективности системы качества и актуализацию стандартных операционных процедур.
Руководитель аптечной организации назначает уполномоченного по качеству, однако никаких требований к квалификации и должностным обязанностям уполномоченного по качеству в аптечной организации не установлено, в частности, не указано на какого сотрудника возлагаются обязанности по приѐмочному контролю лекарственных средств.
Руководитель аптечной организации самостоятельно назначает ответственных за приѐмочный контроль сотрудников из числа фармацевтических работников организации (провизоров или фармацевтов).
Никаких дополнительных документов, подтверждающих право сотрудника заниматься приѐмочным контролем лекарственных средств, не требуется.
-
Приѐмка товаров в аптеке осуществляется в соответствие с условиями, указанными в договоре поставки, а также требованиями «Инструкции о порядке приѐмки продукции производственно-технического назначения и товаров народного потребления по количеству» П-6 от 15.06.65 г. (с дополнениями и изменениями) и «Инструкции о порядке приѐмки продукции производственно-технического назначения и товаров народного потребления по качеству» П-7 от 25.04.66 г. (с дополнениями и изменениями).
Основанием для приѐмки являются товарные документы - товарные накладные, товарно-транспортные накладные.
-
В соответствии с приказом Минздравсоцразвития РФ от 23.08.2010 г. № 706н «Об утверждении правил хранения лекарственных средств» помещения для хранения лекарственных средств должны быть оснащены приборами для регистрации параметров воздуха (термометрами, гигрометрами (электронными гигрометрами) или
психрометрами).
Измерительные части этих приборов должны размещаться на расстоянии не менее 3 м от дверей, окон и отопительных приборов.
Приборы и (или) части приборов, с которых производится визуальное считывание показаний, должны располагаться в доступном для персонала месте на высоте 1,5-1,7 м от пола.
Показания этих приборов должны ежедневно регистрироваться в специальном журнале (карте) регистрации на бумажном носителе или в электронном виде с архивацией (для электронных гигрометров), который ведѐтся ответственным лицом. Журнал (карта) регистрации хранится в течение одного года, не считая текущего. Контролирующие приборы должны быть сертифицированы, калиброваны и подвергаться поверке в установленном порядке.
Лекарственное растительное сырьѐ хранится при комнатной температуре. В соответствии с ОФС 1.1.0011.15 «Хранение лекарственного растительного сырья и лекарственных растительных препаратов» лекарственное растительное сырьѐ, требующее хранения при температуре отличной от комнатной, должно иметь соответствующую маркировку.
Лекарственное растительное сырьѐ и лекарственные растительные препараты следует хранить при относительной влажности воздуха не более 60 ± 5% в зависимости от соответствующей климатической зоны (I, II, III и IVA) и физико-химических свойств лекарственного растительного сырья/препарата и биологически активных веществ, входящих в его состав, в упакованном виде в соответствии с ОФС «Упаковка, маркировка и транспортирование лекарственного растительного сырья и лекарственных растительных препаратов».
Лекарственное растительное сырьѐ и лекарственные растительные препараты не должны подвергаться длительному воздействию прямого или яркого рассеянного солнечного света.
Лекарственные растительные средства, требующие защиты от света, должны храниться в защищѐнном от света месте и/или в светозащитной упаковке.
-
Приказом Министерства здравоохранения Российской Федерации от 22 апреля 2014 г. N 183н «Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно-количественному учѐту» утверждѐн перечень лекарственных средств, подлежащих предметно-количественному учѐту.
-
Лекарственные средства - фармацевтические субстанции и лекарственные препараты, содержащие наркотические средства, психотропные вещества и их прекурсоры.
-
Лекарственные средства - фармацевтические субстанции и лекарственные препараты, содержащие сильнодействующие и ядовитые вещества.
-
Комбинированные лекарственные препараты, содержащие кроме малых количеств наркотических средств, психотропных веществ и их прекурсоров, другие фармакологические активные вещества.
Чистотела трава не относится к указанным группам, поэтому не регистрируется в журнале предметно-количественного учѐта.
-
-
В соответствии с ОФС 1.1.0011.15 г. «Хранение лекарственного растительного сырья и лекарственных растительных препаратов» основная масса лекарственного растительного сырья хранится в зонах для основного хранения сырья.
Изолированно от других видов сырья следует хранить:
-
плоды и семена в отдельной зоне для хранения;
-
эфирномасличное сырьѐ, обладающее запахом, в хорошо укупоренной таре (в том числе, плотно укупоренные мешки, тюки, кипы тканевые);
-
ядовитое и сильнодействующее сырьѐ (в отдельном помещении или в отдельном шкафу под замком).
СИТУАЦИОННАЯ ЗАДАЧА K002502
-
Требования-накладные выписываются согласно приказу МЗ РФ № 110 (Приложение 13, п. 3.1).
Для обеспечения лечебно-диагностического процесса медицинские организации получают лекарственные препараты из аптечной организации по требованиям-накладным, утверждѐнным в установленном порядке.
Требование-накладная на получение из аптечных организаций лекарственных препаратов должна иметь штамп, круглую печать медицинской организации, подпись еѐ руководителя или его заместителя по лечебной части.
В требовании-накладной указывается номер, дата составления документа, отправитель и получатель лекарственного препарата, наименование лекарственного препарата (с указанием дозировки, формы выпуска (таблетки, ампулы, мази, суппозитории и т.п.), вид упаковки (коробки, флаконы, тубы и т.п.), способ применения (для инъекций, для наружного применения, приѐма внутрь, глазные капли и т.п.), количество затребованных лекарственных препаратов, количество и стоимость отпущенных лекарственных препаратов.
Наименования лекарственных препаратов пишутся на латинском языке.
Требования-накладные на лекарственные средства, подлежащие предметно- количественному учѐту, выписываются на отдельных бланках требований-накладных для каждой группы препаратов.
Медицинские организации при составлении заявок на наркотические средства и психотропные вещества списков II и III должны руководствоваться расчѐтными нормативами, утверждѐнными в установленном порядке.
-
Трамадол – сильнодействующее вещество (Постановление Правительства РФ от 29 декабря 2007 г. N 964 «Об утверждении списков сильнодействующих и ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации, а также крупного размера сильнодействующих веществ для целей статьи 234 Уголовного кодекса Российской Федерации»).
Трамадол подлежит ПКУ (Приказ Минздрава России от 22.04.2014 г. N 183н «Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно-количественному учѐту»).
При оформлении требования-накладной не соблюдены требования приказа Минздравсоцразвития России от 12.02.2007 г. N 110 (ред. от 26.02.2013 г.) «О порядке
назначения и выписывания лекарственных препаратов, изделий медицинского назначения и специализированных продуктов лечебного питания» в части: наименования лекарственных препаратов пишутся на латинском языке.
Требования-накладные на лекарственные средства, подлежащие предметно- количественному учѐту (Трамадол), выписываются на отдельных бланках требований- накладных для каждой группы препаратов.
Кроме того, превышен крупный размер сильнодействующих веществ для целей статьи 234 УК РФ (утв. ПП РФ 964): крупный размер оборота Трамадола составляет 10 г и выше.
Чтобы выяснить, превышен ли особо крупный размер в задаче, необходимо рассчитать количество Трамадола в 12 упаковках:
100 мг = 0,1 г
0,1 × 20 × 12 = 24 г, что больше 10 г.
-
Трамадол входит в перечень ЖНВЛП (Распоряжение Правительства РФ от 28.12.2016 г. N 2885-р об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2017 год).
Протокол согласования цен – обязательный сопроводительный документ при реализации лекарственных препаратов из перечня жизненно необходимых и важнейших лекарственных препаратов (Постановление Правительства РФ от 29.10.2010 г. № 865 «О государственном регулировании цен на лекарственные препараты, включѐнные в перечень жизненно необходимых и важнейших лекарственных препаратов»).
Форма протокола согласования цен поставки жизненно необходимых и важнейших лекарственных препаратов установлена Постановлением Правительства РФ от 08.08.2009 г. № 654 «О совершенствовании государственного регулирования цен на лекарственные препараты, включѐнные в Перечень жизненно необходимых и важнейших лекарственных препаратов».
Все поступающие лекарственные средства (независимо от источника их поступления) подвергаются приѐмочному контролю (Приказ Минздрава России от 26.10.2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность»).
Приѐмочный контроль заключается в проверке поступающих лекарственных средств на соответствие требованиям по показателям: «Описание», «Упаковка»,
«Маркировка», а также в проверке правильности оформления сопроводительных документов, включая документы, подтверждающие качество лекарственных средств.

-
Производятся записи в «Журнале учѐта операций, связанных с обращением лекарственных средств для медицинского применения».
Правила ведения Журнала – приказ Минздрава России от 17.06.2013 г. N 378н «Об утверждении правил регистрации операций, связанных с обращением лекарственных средств для медицинского применения, включѐнных в перечень лекарственных средств для медицинского применения, подлежащих предметно-количественному учѐту, в специальных журналах учѐта операций, связанных с обращением лекарственных средств для медицинского применения, и правил ведения и хранения специальных журналов учѐта операций, связанных с обращением лекарственных средств для медицинского применения».
Журналы учѐта, заполняемые на бумажном носителе, сброшюровываются, пронумеровываются и скрепляются подписью руководителя юридического лица (индивидуального предпринимателя) и печатью юридического лица (индивидуального предпринимателя) перед началом их ведения.
Журналы учѐта оформляются на календарный год.
Листы журналов учѐта, заполняемых в электронной форме, ежемесячно распечатываются, нумеруются, подписываются лицом, уполномоченным на ведение и хранение журналов учѐта, и брошюруются по наименованиям лекарственного средства, дозировке, лекарственной форме.
По истечении календарного года сброшюрованные листы оформляются в журнал, опечатываются с указанием количества листов и заверяются подписью лица, уполномоченного на ведение и хранение журналов учѐта, руководителя юридического лица (индивидуального предпринимателя) и печатью юридического лица (индивидуального предпринимателя).
Записи в журналах учѐта производятся лицом, уполномоченным на ведение и
хранение журнала учѐта, шариковой ручкой (чернилами) в конце рабочего дня на основании документов, подтверждающих совершение приходных и расходных операций с лекарственным средством.
Поступление лекарственного средства отражается в журнале учѐта по каждому приходному документу в отдельности с указанием номера и даты. Расход лекарственного средства записывается ежедневно. Аптечные организации и индивидуальные предприниматели, имеющие лицензии на фармацевтическую деятельность, записывают ежедневный расход лекарственного средства с указанием отдельно по рецептам, выписанным медицинским работникам, и по требованиям медицинских организаций.
Исправления в журналах учѐта заверяются подписью лица, уполномоченного на ведение и хранение журналов учѐта. Подчистки и незаверенные исправления в журналах учѐта не допускаются.
На последнее число каждого месяца лицо, уполномоченное на ведение и хранение журналов учѐта, проводит сверку фактического наличия лекарственных средств с их остатком по журналу учѐта и вносит соответствующие записи в журнал учѐта.
Журнал учѐта хранится в металлическом шкафу (сейфе), ключи от которого находятся у лица, уполномоченного на ведение и хранение журнала учѐта.
Приходные и расходные документы (их копии) подшиваются в порядке их поступления по датам и хранятся вместе с журналом учѐта.
Заполненные журналы учѐта хранятся в архиве юридического лица (индивидуального предпринимателя).
Срок хранения журнала – 3 года.
Срок хранения требования-накладной на Трамадол – 3 года (Приказ Минздравсоцразвития России от 14.12.2005 г. N 785 «О Порядке отпуска лекарственных средств»).
-
Нормативные документы.
Постановление Правительства РФ от 29.10.2010 г. № 865 «О государственном регулировании цен на лекарственные препараты, включѐнные в перечень жизненно необходимых и важнейших лекарственных препаратов».
Постановление Правительства РФ от 08.08.2009 г. № 654 «О совершенствовании государственного регулирования цен на лекарственные препараты, включѐнные в перечень жизненно необходимых и важнейших лекарственных препаратов». Распоряжение Правительства РФ «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов».
Постановление Правительства Нижегородской области от 22.03.2011 г. № 193 «Об установлении предельных размеров оптовых и предельных размеров розничных надбавок к фактическим отпускным ценам производителей на лекарственные препараты, включѐнные в перечень жизненно необходимых и важнейших лекарственных препаратов».
В соответствии с этими НД установлены следующие предельные розничные надбавки, исчисленные к фактической отпускной цене производителя для ЛП, предназначенных для свободной продажи населению:
-
на ЖНВЛП стоимостью до 50 рублей включительно – в размере 33%,
-
на ЖНВЛП стоимостью свыше 50 рублей до 500 рублей включительно – 27%,
-
на ЖНВЛП стоимостью свыше 500 рублей – 20%,
-
письмо ФАС:
Действующими Правилами установления предельных размеров оптовых и предельных размеров розничных надбавок к фактическим отпускным ценам производителей на лекарственные препараты, включѐнные в перечень жизненно необходимых и важнейших лекарственных препаратов, в субъектах Российской Федерации, утверждѐнных постановлением Правительства Российской Федерации от 29.10.2010 г. № 865, предусмотрен расчѐт оптовой и (или) розничной надбавки к фактической отпускной цене производителя на ЖНВЛП без налога на добавленную стоимость (далее – НДС).
В связи с этим:
-
организациям розничной торговли, находящимся на общей системе налогообложения (то есть являющимся плательщиками НДС), необходимо формировать отпускную цену на ЖНВЛП, суммируя цену приобретения ЖНВЛП без НДС (если поставщик ЖНВЛП является плательщиком ЕНВД или находится на УСН, то есть не является плательщиком НДС, фактическую цену приобретения ЖНВЛП у такого поставщика), надбавку (размер которой не превышает предельный размер оптовой или розничной надбавки, установленный в субъекте Российской Федерации для данной ценовой группы), исчисленную от фактической отпускной цены производителя без НДС, и налог на добавленную стоимость, исчисленный от суммы, полученной в результате сложения вышеуказанных цены приобретения и надбавки.
-
организации розничной торговли, находящиеся на УСН 1 или являющиеся плательщиками ЕНВД, формируют отпускную цену на ЖНВЛП, суммируя цену приобретения ЖНВЛП у поставщика (реальные расходы организации на приобретение ЖНВЛП, независимо от режима налогообложения, применяемого поставщиком) и надбавку (размер которой не превышает предельный размер оптовой или розничной надбавки, установленный в субъекте Российской Федерации для данной ценовой группы), исчисленную от фактической отпускной цены производителя без НДС.
СИТУАЦИОННАЯ ЗАДАЧА K002503
-
Вакцина для профилактики гриппа. Флюарикс обеспечивает защиту на текущий сезон гриппа. Индуцирует выработку нейтрализующих антител к гемагглютинину вирусов гриппа в защитном титре.
Цель использования – профилактика гриппа у детей старше 6 месяцев и взрослых. Вакцинация против гриппа показана детям, посещающим дошкольные учреждения;
учащимся 1–11 классов; студентам высших профессиональных и средних профессиональных учебных заведений; взрослым, работающим по отдельным профессиям и должностям (работникам медицинских и образовательных учреждений, транспорта, коммунальной сферы и др.); взрослым старше 60 лет.
Кроме этих категорий, вакцинация против гриппа особенно рекомендуется лицам с заболеваниями сердечно-сосудистой системы, хронической почечной недостаточностью, заболеваниями обмена веществ (сахарный диабет), муковисцидозом, хроническими
респираторными заболеваниями, а также лицам с первичным и приобретенным иммунодефицитом. Вакцинация также показана остальным группам населения.
Вакцинацию следует проводить ежегодно в возрастной дозировке с использованием препарата, имеющего антигенный состав, рекомендованный для данного эпидсезона.
Вакцинируемый должен находиться под наблюдением врача в течение 30 мин. после иммунизации.
-
Данный лекарственный препарат относится к иммунобиологическим лекарственным препаратам (далее ИЛП).
Иммунобиологические лекарственные препараты – лекарственные препараты, предназначенные для формирования активного или пассивного иммунитета либо диагностики наличия иммунитета или диагностики специфического приобретѐнного изменения иммунологического ответа на аллергизирующие вещества.
К иммунобиологическим лекарственным препаратам относятся вакцины, анатоксины, токсины, сыворотки, иммуноглобулины и аллергены (Федеральный закон РФ от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств»).
Хранение в аптеках ИЛП осуществляется в соответствии с постановлением Главного государственного санитарного врача РФ от 17.02.2016 г. № 19 «Об утверждении санитарно-эпидемиологических правил» СП 3.3.2.3332-16 «Условия транспортирования и хранения иммунобиологических лекарственных препаратов».
На третьем уровне «холодовой цепи» – в аптеке – ИЛП хранятся в холодильных камерах или в холодильниках при температуре, соответствующей требованиям нормативных документов на препараты.
В системе «холодовой цепи» для хранения ИЛП используются особые холодильники, характеризующиеся высокой степенью надѐжности (холодильники для
«холодовой цепи»), с технической возможностью длительного (не менее 24 часов) удержания надлежащего температурного режима внутри холодильной камеры при отключении электроэнергии, стабильностью температурного режима внутри камеры, не допускающего выход за пределы интервала температур в пределах от +2 °C до +8 °C.
Не допускается совместное хранение в холодильнике ИЛП и других ЛП.
Полки холодильника, выделенные для хранения отдельных ИЛП, маркируются соответствующим образом. Не допускается размещение ИЛП на полках дверной панели холодильника.
Не допускается превышение объѐма загрузки холодильного оборудования более чем на 2/3.
В качестве аварийных источников холода в стационарном холодильном оборудовании должны всегда быть в наличии хладоэлементы в комплекте с термоконтейнерами.
Для непрерывного контроля за параметрами температуры в холодильном оборудовании для хранения ИЛП и термоконтейнерах используются терморегистраторы.
Терморегистратор – прибор, предназначенный для измерения, автоматической записи, хранения и воспроизведения на электронном и/или бумажном носителе значений температуры (в пределах установленной погрешности) с привязкой к реальной шкале
времени.
Также для контроля температуры в холодильном оборудовании могут использоваться и термометры.
Контроль показаний каждого термометра осуществляется два раза в сутки (в начале и в конце рабочего дня). Показания термометров регистрируются в специальном журнале мониторинга температуры (Журнал регистрации температуры в холодильном оборудовании для хранения ИЛП), который заполняется отдельно на каждую единицу холодильного оборудования.
-
Провизор нарушил нормативные требования к хранению данного лекарственного препарата: поместил Флюарикс вместе с другими лекарственным препаратам, а нужно было в отдельный холодильник для хранения ИЛП на полку, подписанную названием данной вакцины.
-
Учѐт поступлений и отправлений ИЛП ведѐтся должностным лицом, ответственным за «холодовую цепь» в специальном журнале (Журнал учѐта движения ИЛП).
-
Данный ИЛП в прививочный кабинет транспортируется в термоконтейнере.
Термоконтейнеры многократного применения должны быть укомплектованы паспортом, термокартой, инструкцией по применению, должны иметь покрытие, легко подвергающееся санитарной обработке.
Запрещается использование термоконтейнеров с механическими повреждениями стенок и/или крышки как внутри, так и снаружи.
Санитарная обработка термоконтейнеров многократного применения проводится перед загрузкой и после использования, а также по мере необходимости, с использованием дезинфицирующих средств в соответствии с паспортом и инструкцией по применению термоконтейнеров.
Загрузка ИЛП (транспортировки из аптеки в прививочный кабинет) производится в термоконтейнер, предварительно охлаждѐнный до температуры от +2 °C до +8 °C.
Между упаковками ИЛП и поверхностью хладоэлементов необходимо размещать изолирующий материал (например, картон или бумагу).
СИТУАЦИОННАЯ ЗАДАЧА K002504
-
Данный лекарственный препарат общеизвестен как Антигриппин. Фармакологическое действие – жаропонижающее, анальгезирующее, противоаллергическое.
Показания – инфекционно-воспалительные заболевания (ОРВИ, грипп), сопровождающиеся повышенной температурой, ознобом, головной болью, болями в суставах и мышцах, заложенностью носа и болями в горле и пазухах носа.
Лекарственная форма – сложный дозированный порошок.
-
Приказ Минздрава России от 26.10.2015 г. N 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность».
Порошки изготавливаются с использованием смесителей и измельчителей или в
ступках с учѐтом их физико-химических свойств.
Для каждого размера ступки имеются максимумы загрузок, которые не должны превышать 000/20 еѐ объѐма, с тем, чтобы обеспечить оптимальное измельчение лекарственных веществ.
Измельчение и смешивание порошков осуществляется путѐм добавления последовательно ингредиентов от меньших количеств к большим количествам в предварительно затѐртой ступке индифферентным в фармакологическом отношении вспомогательным веществом или лекарственным средством с соблюдением потерь в соответствии с таблицей N 2 приложения N 2 приказа Минздрава России от 26.10.2015 г. N 751н.
Остальные ингредиенты при изготовлении порошков добавляются в порядке увеличения их массы при соблюдении соотношения 1:20.
Лекарственные средства, обладающие красящими свойствами, добавляются в ступку на последнем этапе смешивания порошков или между слоями не красящих лекарственных средств.
Ступка № 3. Поры ступки затираются ацетилсалициловой кислотой. Последовательно измельчаются ацетилсалициловая кислота, аскорбиновая кислота, кальция глюконат, димедрол, рутин (красит) – последним. Порошок измельчается до однородности.
Смесь для изготовления порошков разделяется на дозы с использованием ручных весов и электронных весов или дозаторов в соответствии с массой одного порошка и их количеством, указанным в рецепте.
Паспорт письменного контроля заполняется сразу после изготовления лекарственного препарата, с указанием лекарственных средств на латинском языке, в соответствии с последовательностью технологических операций.
Паспорта письменного контроля хранятся в течение двух месяцев со дня изготовления лекарственных препаратов.
Все расчѐты для изготовления лекарственного препарата производятся до изготовления лекарственного препарата и записываются в паспорте письменного контроля.
Если в состав лекарственного препарата входят наркотические средства, психотропные, ядовитые и сильнодействующие вещества, а также другие лекарственные средства, подлежащие предметно-количественному учѐту, их количество указывается на оборотной стороне рецепта.
В случае если лекарственные препараты изготавливаются и отпускаются одним и тем же лицом, паспорт письменного контроля заполняется в процессе изготовления лекарственного препарата.
Если провизором-аналитиком проведѐн полный химический контроль качества изготовленного лекарственного препарата, то на паспорте письменного контроля проставляется номер химического анализа и подпись провизора-аналитика.
-
Приказ Минздрава России от 26.10.2015 г. N 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию
на фармацевтическую деятельность».
Контроль качества изготавливаемых и изготовленных лекарственных препаратов осуществляется посредством: приѐмочного контроля, письменного контроля, опросного контроля, органолептического контроля, физического контроля, химического контроля, контроля при отпуске лекарственных препаратов.
Все изготовленные лекарственные препараты подлежат обязательному письменному, органолептическому контролю при отпуске.
Письменный контроль:
Изготовленные лекарственные препараты, рецепты и требования, по которым изготовлены лекарственные препараты, заполненные паспорта письменного контроля передаются на проверку провизору, выполняющему контрольные функции при изготовлении и отпуске лекарственных препаратов.
Контроль заключается в проверке соответствия записей в паспорте письменного контроля назначениям в рецепте или требовании, правильности произведѐнных расчѐтов.
Опросный контроль:
Опросный контроль осуществляется выборочно и проводится после изготовления фармацевтом (провизором) не более пяти лекарственных форм.
При проведении опросного контроля провизором, осуществляющим контрольную функцию, называется первое входящее в состав лекарственного препарата лекарственное средство, а в лекарственных препаратах сложного состава указывается также его количество, после чего фармацевтом (провизором) указываются все иные используемые лекарственные средства и их количества.
Органолептический контроль:
Органолептический контроль является обязательным видом контроля и заключается в проверке лекарственного препарата по внешнему виду, запаху, однородности смешивания, отсутствию механических включений в жидких лекарственных формах. На вкус проверяются выборочно лекарственные формы, предназначенные для детей.
Физический контроль:
Физический контроль заключается в проверке общей массы или объѐма лекарственного препарата, количества и массы отдельных доз (не менее трѐх доз), входящих в лекарственный препарат.
Химический контроль:
Химический контроль заключается в оценке качества изготовления лекарственных препаратов по показателям:
-
качественный анализ: подлинность лекарственных средств;
-
количественный анализ: количественное определение лекарственных средств.
Для проведения химического контроля оборудуется специальное рабочее место, оснащѐнное необходимым оборудованием, приборами и реактивами, обеспеченное документами в области контроля качества и справочной литературой.
Контроль при отпуске:
Контролю при отпуске лекарственных препаратов подвергаются все изготовленные лекарственные препараты, в рамках которого проверяется соответствие:
а) упаковки лекарственного препарата физико-химическим свойствам, входящих в него лекарственных средств;
б) указанных в рецепте или требовании доз наркотических средств, психотропных, сильнодействующих веществ возрасту пациента;
в) реквизитов рецепта, требования сведениям, указанным на упаковке изготовленного лекарственного препарата;
г) маркировки лекарственного препарата.
-
-
Результаты органолептического, физического и химического контроля изготовленных лекарственных препаратов регистрируются в журнале регистрации результатов органолептического, физического и химического контроля лекарственных препаратов, изготовленных по рецептам, требованиям и в виде внутриаптечной заготовки, концентрированных растворов, тритураций, спирта этилового и фасовки лекарственных средств.
В данном журнале указываются следующие сведения: а) дата осуществления контроля и номер по порядку;
б) номер рецепта, требования, наименование медицинской организации, выдавшей их (при наличии);
в) номер серии лекарственного средства промышленного производства;
г) состав лекарственного средства: определяемое вещество или ион (указывается при физическом или химическом контроле лекарственных форм, изготовленных по рецептам);
д) результаты физического, органолептического, качественного контроля (каждый по шкале: положительный или отрицательный), химического контроля (качественное и количественное определение);
е) ФИО лица, изготовившего, расфасовавшего лекарственный препарат; ж) подпись лица, проверившего изготовленный лекарственный препарат;
з) заключение по результатам письменного контроля: удовлетворительно или неудовлетворительно.
Журнал регистрации результатов органолептического, физического и химического контроля лекарственных препаратов, изготовленных по рецептам, требованиям и в виде внутриаптечной заготовки, концентрированных растворов, тритураций, спирта этилового и фасовки лекарственных средств должен быть пронумерован, прошнурован и скреплѐн подписью руководителя аптечной организации (индивидуального предпринимателя) и печатью (при наличии печати).
-
Приказ Минздрава России от 26.10.2015 г. N 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность»:
Каждая доза порошка заворачивается в капсулу, капсулы помещаются в бумажный
пакет.
Упаковка изготовленных лекарственных препаратов осуществляется в зависимости
от формы и способа применения лекарственного препарата.
В процессе упаковки изготовленных лекарственных препаратов осуществляется
проверка общего вида упаковки, правильности использования упаковочных материалов, маркировки упаковки.
Маркировка:
-
Все лекарственные препараты, изготовленные и расфасованные в аптечной организации или индивидуальным предпринимателем, имеющим лицензию на фармацевтическую деятельность, оформляются соответствующими этикетками.
-
Этикетка для оформления лекарственных препаратов в зависимости от способа их применения. Этикетка для данного ЛП – как для ЛП для внутреннего применения – с надписью: «Внутреннее».
-
Этикетка имеет на белом фоне следующие сигнальные цвета в виде поля: так как для внутреннего применения – зелѐный цвет.
-
На всех этикетках для оформления изготовленных лекарственных препаратов должны быть отпечатаны предупредительные надписи, соответствующие каждой лекарственной форме, но для данного порошка не предусмотрены.
-
Этикетка обязательно должна содержать предупредительную надпись: «Хранить в недоступном для детей месте».
-
Размер этикетки определяется в соответствии с размерами посуды или другой упаковки, в которой отпускаются изготовленные лекарственные препараты.
-
Лекарственные препараты в зависимости от лекарственной формы и назначения следует оформлять соответствующими видами этикеток: данную – «Порошки».
-
На этикетках для оформления лекарственных препаратов, изготовленных для населения, должно быть указано:
а) наименование аптечной организации, ФИО индивидуального предпринимателя, имеющего лицензию на фармацевтическую деятельность;
б) местонахождение аптечной организации или место фармацевтической деятельности индивидуального предпринимателя;
в) номер рецепта (присваивается в аптеке); г) ФИО пациента;
д) наименование или состав лекарственного препарата;
е) способ применения лекарственного препарата (внутреннее, наружное, для инъекций), вид лекарственной формы (глазные капли, мазь и т.д.);
ж) подробное описание способа применения;
з) дата изготовления лекарственного препарата;
и) срок годности лекарственного препарата («Годен до к) цена лекарственного препарата;
»);
языке.
л) предостережение «Хранить в недоступном для детей месте».
-
Текст этикетки должен быть напечатан типографским способом на русском
Состав лекарственного препарата пишется от руки или наносится штампом. Наименования лекарственных препаратов, часто встречающихся в рецептуре, таких
как Антигриппин, или изготовляемых в виде внутриаптечной заготовки, могут быть напечатаны типографским способом.
СИТУАЦИОННАЯ ЗАДАЧА K002505
-
Требования-накладные выписываются согласно приказу МЗ РФ №110 (Приложение 13, п. 3.1).
Для обеспечения лечебно-диагностического процесса медицинские организации получают лекарственные препараты из аптечной организации по требованиям-накладным, утверждѐнным в установленном порядке.
Требование-накладная на получение из аптечных организаций лекарственных препаратов должна иметь штамп, круглую печать медицинской организации, подпись еѐ руководителя или его заместителя по лечебной части. В требовании-накладной указывается номер, дата составления документа, отправитель и получатель лекарственного препарата, наименование лекарственного препарата (с указанием дозировки, формы выпуска (таблетки, ампулы, мази, суппозитории и т.п.), вид упаковки (коробки, флаконы, тубы и т.п.), способ применения (для инъекций, для наружного применения, приѐма внутрь, глазные капли и т.п.), количество затребованных лекарственных препаратов, количество и стоимость отпущенных лекарственных препаратов.
Наименования лекарственных препаратов пишутся на латинском языке.
Требования-накладные на лекарственные средства, подлежащие предметно- количественному учѐту, выписываются на отдельных бланках требований-накладных для каждой группы препаратов.
Медицинские организации при составлении заявок на наркотические средства и психотропные вещества списков II и III должны руководствоваться расчѐтными нормативами, утверждѐнными в установленном порядке.
-
Промедол – наркотическое средство (Постановление Правительства РФ от 30 июня 1998 г. N 681 «Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации»).
Промедол подлежит ПКУ (Приказ Минздрава России от 22.04.2014 г. N 183н «Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно-количественному учѐту»).
При оформлении требования-накладной не соблюдены требования приказа Минздравсоцразвития России от 12.02.2007 г. N 110 (ред. от 26.02.2013 г.) «О порядке назначения и выписывания лекарственных препаратов, изделий медицинского назначения и специализированных продуктов лечебного питания»; в части:
Наименования лекарственных препаратов пишутся на латинском языке.
Требования-накладные на лекарственные средства, подлежащие предметно- количественному учѐту (Промедол), выписываются на отдельных бланках требований- накладных для каждой группы препаратов.
-
Все поступающие лекарственные средства (независимо от источника их поступления) подвергаются приѐмочному контролю (Приказ Минздрава России от 26.10.2015 г. № 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность».
Приѐмочный контроль заключается в проверке поступающих лекарственных
средств на соответствие требованиям по показателям: «Описание», «Упаковка»,
«Маркировка», а также в проверке правильности оформления сопроводительных документов, включая документы, подтверждающие качество лекарственных средств.
Договор поставки – соглашение сторон, заключаемое в письменной форме, в силу которого поставщик обязуется поставить покупателю в обусловленные сроки определѐнные товары, а покупатель принять и оплатить эти товары.
Договор поставки является основным документом, подтверждающим правомерность нахождения товара в собственности аптеки и составляется, как правило в двух экземплярах. Все другие сопроводительные документы составляются только на основании договора.
Накладная является первичным документом, который составляется в 2 экземплярах и служит доказательством передачи и основанием для списания (принятия на учѐт) товара. Накладная должна содержать подпись и печать продавца и покупателя. Она составляется в двух экземплярах, один из них остаѐтся у поставщика, второй - у получателя.
Счѐт-фактура – это документ строго установленного образца, который выписывается продавцом покупателю после отпуска товара и служит основанием для принятия к вычету или возмещению налога на добавленную стоимость.
Протокол согласования цен – обязательный сопроводительный документ при реализации лекарственных препаратов из перечня жизненно необходимых и важнейших лекарственных препаратов (Постановление Правительства РФ от 29.10.2010 г. № 865 «О государственном регулировании цен на лекарственные препараты, включѐнные в перечень жизненно необходимых и важнейших лекарственных препаратов»).
Форма протокола согласования цен поставки жизненно необходимых и важнейших лекарственных препаратов установлена постановлением Правительства РФ от 08.08.2009 г. №654 «О совершенствовании государственного регулирования цен на лекарственные препараты, включѐнные в Перечень жизненно необходимых и важнейших лекарственных препаратов».
Протокол согласования цены не носит самостоятельного характера, он выступает в качестве приложения к договору, то есть его неотъемлемой части. Подтверждает документально согласование аптеки с ценами поставщика для контроля за величиной торговой надбавки и ценой производителя.
-
Промедол – наркотическое средство (Постановление Правительства РФ от 30 июня 1998 г. N 681 «Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации»).
Ведѐтся Журнал регистрации операций, связанных с оборотом наркотических средств и психотропных веществ.
Постановление Правительства РФ от 04.11.2006 г. N 644 (ред. от 29.12.2016 г.) «О порядке представления сведений о деятельности, связанной с оборотом наркотических средств и психотропных веществ, и регистрации операций, связанных с оборотом наркотических средств и психотропных веществ».
Ведѐтся по каждому наименованию наркотического средства и психотропного вещества на отдельном развѐрнутом листе журнала.
Журналы регистрации должны быть сброшюрованы, пронумерованы и скреплены
подписью руководителя юридического лица и печатью юридического лица.
Руководитель юридического лица назначает лиц, ответственных за ведение и хранение журналов регистрации, в том числе в подразделениях.
Записи в журналах регистрации производятся лицом, ответственным за их ведение и хранение, шариковой ручкой (чернилами) с периодичностью, устанавливаемой руководителем юридического лица, но не реже одного раза в течение дня совершения операций с наркотическими средствами и психотропными веществами на основании документов, подтверждающих совершение этих операций.
Документы или их копии, подтверждающие совершение операции с наркотическим средством или психотропным веществом, заверенные в установленном порядке, подшиваются в отдельную папку, которая хранится вместе с соответствующим журналом регистрации.
Нумерация записей в журналах регистрации по каждому наименованию наркотического средства или психотропного вещества осуществляется в пределах календарного года в порядке возрастания номеров.
Запись в журналах регистрации каждой проведѐнной операции заверяется подписью лица, ответственного за их ведение и хранение.
Исправления в журналах регистрации заверяются подписью лица, ответственного за их ведение и хранение. Подчистки и незаверенные исправления в журналах регистрации не допускаются.
Юридические лица ежемесячно проводят в установленном порядке инвентаризацию наркотических средств и психотропных веществ путѐм сопоставления их фактического наличия с данными учѐта (книжными остатками).
Срок хранения Журнала 10 лет.
Срок хранения требования-накладной на Промедол – 10 лет.
(Приказ Минздравсоцразвития России от 14.12.2005 г. N 785 «О Порядке отпуска лекарственных средств»).
-
Приказ Минздрава России от 22.04.2014 г. N 183н «Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно- количественному учѐту»:
-
-
Лекарственные средства - фармацевтические субстанции и лекарственные препараты, содержащие наркотические средства, психотропные вещества и их прекурсоры (их соли, изомеры, стереоизомеры), включѐнные в списки II, III, IV перечня наркотических средств, психотропных веществ и их прекурсоров, в сочетании с фармакологически неактивными веществами, а также лекарственные препараты, содержащие наркотические средства, психотропные вещества и их прекурсоры в сочетании с фармакологически активными веществами (при условии включения их в перечень отдельной позицией).
-
Лекарственные средства - фармацевтические субстанции и лекарственные препараты, содержащие сильнодействующие и ядовитые вещества (их соли, изомеры, простые и сложные эфиры, смеси и растворы независимо от концентрации), внесѐнные в списки сильнодействующих и ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации, утверждѐнные постановлением
Правительства Российской Федерации от 29 декабря 2007 г. N 964 <1> (далее - сильнодействующие и ядовитые вещества), в сочетании с фармакологически неактивными веществами, а также лекарственные препараты, содержащие сильнодействующие и ядовитые вещества в сочетании с фармакологически активными веществами (при условии включения их в перечень отдельной позицией).
-
Комбинированные лекарственные препараты, содержащие кроме малых количеств наркотических средств, психотропных веществ и их прекурсоров другие фармакологические активные вещества <1>.
-
Иные лекарственные средства, подлежащие предметно-количественному учѐту: Прегабалин (лекарственные препараты),
Тропикамид (лекарственные препараты), Циклопентолат (лекарственные препараты).
СИТУАЦИОННАЯ ЗАДАЧА K002506
-
Вакцина для профилактики гриппа.
Ваксигрип формирует развитие специфического иммунитета к эпидемически актуальным штаммам вируса гриппа типов А и В, содержащихся в данной вакцине.
Иммунитет вырабатывается между 2 и 3 неделей после вакцинации и сохраняется от 6 до 12 месяцев.
Вакцинируемый должен находиться под наблюдением врача в течение 30 мин. после иммунизации.
-
Данный лекарственный препарат относится к иммунобиологическим лекарственным препаратам (далее ИЛП).
Иммунобиологические лекарственные препараты – лекарственные препараты, предназначенные для формирования активного или пассивного иммунитета либо диагностики наличия иммунитета или диагностики специфического приобретѐнного изменения иммунологического ответа на аллергизирующие вещества.
К иммунобиологическим лекарственным препаратам относятся вакцины, анатоксины, токсины, сыворотки, иммуноглобулины и аллергены (Федеральный закон РФ от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств»).
Хранение в аптеках ИЛП осуществляется в соответствии с постановлением Главного государственного санитарного врача РФ от 17.02.2016 г. № 19 «Об утверждении санитарно-эпидемиологических правил СП 3.3.2.3332-16 «Условия транспортирования и хранения иммунобиологических лекарственных препаратов».
На третьем уровне «холодовой цепи» – в аптеке – ИЛП хранятся в холодильных камерах или в холодильниках при температуре, соответствующей требованиям нормативных документов на препараты.
В системе «холодовой цепи» для хранения ИЛП используются особые холодильники, характеризующиеся высокой степенью надѐжности (холодильники для
«холодовой цепи»), с технической возможностью длительного (не менее 24 часов) удержания надлежащего температурного режима внутри холодильной камеры при отключении электроэнергии, стабильностью температурного режима внутри камеры, не допускающего выход за пределы интервала температур в пределах от +2 °C до +8 °C.
Не допускается совместное хранение в холодильнике ИЛП и других ЛП.
Полки холодильника, выделенные для хранения отдельных ИЛП, маркируются соответствующим образом. Не допускается размещение ИЛП на полках дверной панели холодильника.
Не допускается превышение объѐма загрузки холодильного оборудования более чем на 2/3.
В качестве аварийных источников холода в стационарном холодильном оборудовании должны всегда быть в наличии хладоэлементы в комплекте с термоконтейнерами.
Для непрерывного контроля за параметрами температуры в холодильном оборудовании для хранения ИЛП и термоконтейнерах используются терморегистраторы.
Терморегистратор – прибор, предназначенный для измерения, автоматической записи, хранения и воспроизведения на электронном и/или бумажном носителе значений температуры (в пределах установленной погрешности) с привязкой к реальной шкале времени.
Также для контроля температуры в холодильном оборудовании могут использоваться и термометры.
Контроль показаний каждого термометра осуществляется два раза в сутки (в начале и в конце рабочего дня).
Показания термометров регистрируются в специальном журнале мониторинга температуры (Журнал регистрации температуры в холодильном оборудовании для хранения ИЛП), который заполняется отдельно на каждую единицу холодильного оборудования.
-
Провизор нарушил нормативные требования к хранению данного лекарственного препарата: поместил недоброкачественный Ваксигрипп на место его постоянного хранения.
Данная вакцина должна была быть помещена в карантинную зону с пометкой
«Забраковано при приѐмке».
-
Учѐт поступлений и отправлений ИЛП ведѐтся должностным лицом, ответственным за «холодовую цепь» в специальном журнале (Журнал учѐта движения ИЛП).
-
Данный ИЛП в прививочный кабинет транспортируется в термоконтейнере.
Термоконтейнеры многократного применения должны быть укомплектованы паспортом, термокартой, инструкцией по применению, должны иметь покрытие, легко подвергающееся санитарной обработке.
Запрещается использование термоконтейнеров с механическими повреждениями стенок и/или крышки как внутри, так и снаружи.
Санитарная обработка термоконтейнеров многократного применения проводится перед загрузкой и после использования, а также по мере необходимости, с использованием дезинфицирующих средств в соответствии с паспортом и инструкцией по применению термоконтейнеров.
Загрузка ИЛП (транспортировки из аптеки в прививочный кабинет) производится в термоконтейнер, предварительно охлаждѐнный до температуры от +2 °C до +8 °C.
Между упаковками ИЛП и поверхностью хладоэлементов необходимо размещать изолирующий материал (например, картон или бумагу).
СИТУАЦИОННАЯ ЗАДАЧА K002507
-
Фармакологическое действие - гидратирующее, дезинтоксикационное, плазмозамещающее, нормализующее КЩС.
Применение: большие потери внеклеточной жидкости (в том числе токсическая диспепсия, холера, диарея, неукротимая рвота, обширные ожоги с сильной экссудацией), гипохлоремия и гипонатриемия с обезвоживанием, кишечная непроходимость, в качестве дезинтоксикационного средства; промывание ран, глаз, полости носа, для растворения и разведения различных лекарственных веществ и увлажнения перевязочного материала.
Лекарственная форма – стерильный раствор для инъекций.
-
Приказ Минздрава России от 26.10.2015 г. N 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность».
Изготовленные инъекционные и инфузионные растворы должны быть свободными от видимых механических включений, стерильными, стабильными, выдерживать испытание на пирогенность.
Дополнительными требованиями для изготовленных инфузионных растворов являются их изотоничность, изогидричность, изоионичность, изовязкость.
Инъекционные и инфузионные растворы изготавливаются в асептических условиях массо-объѐмным методом на воде для инъекций.
Запрещается одновременное изготовление на одном рабочем месте нескольких инъекционных и инфузионных растворов, содержащих лекарственные средства с различными наименованиями или лекарственные средства одного наименования в разных концентрациях.
Инъекционные и инфузионные растворы фильтруются с использованием разрешѐнных к применению фильтровальных материалов и установок. Фильтрование раствора сочетается с одновременным розливом его в подготовленные стерильные флаконы, которые укупориваются стерильными пробками.
Интервал времени от начала изготовления инъекционного и инфузионного раствора до стерилизации не должен превышать 3 часов.
Инъекционные и инфузионные растворы стерилизуются в соответствии с требованиями к режимам стерилизации, указанными в таблице N 1 приложения N 15 к приказу Минздрава России от 26.10.2015 г. N 751н.
Не допускаются стерилизация растворов объѐмом более 1 литра и повторная стерилизация инъекционных и инфузионных растворов.
Процесс стерилизации должен обеспечивать эффективность стерилизации всего объѐма загрузки.
Контроль параметров и эффективности термических методов стерилизации осуществляется с помощью контрольно-измерительных приборов, химических и биологических тестов.
Режимы стерилизации исходных лекарственных средств, изготовленных инъекционных и инфузионных растворов, а также вспомогательных материалов и посуды регистрируются в журнале регистрации режима стерилизации исходных лекарственных средств, изготовленных лекарственных препаратов, вспомогательных материалов, посуды и прочих материалов.
В журнале регистрации режима стерилизации исходных лекарственных средств, изготовленных лекарственных препаратов, вспомогательных материалов, посуды и прочих материалов указываются следующие сведения:
а) дата и порядковый номер проведения стерилизации; б) номер рецепта или требования;
в) наименование материала, подлежащего стерилизации;
г) количество исходных лекарственных средств, изготовленных лекарственных препаратов, вспомогательных материалов, посуды и прочих материалов;
д) условия стерилизации (температура, время); е) термотест;
ж) подпись лица, проводившего стерилизацию материалов.
Журнал регистрации режима стерилизации исходных лекарственных средств, изготовленных лекарственных препаратов, вспомогательных материалов, посуды и прочих материалов должен быть пронумерован, прошнурован и скреплѐн подписью руководителя аптечной организации (индивидуального предпринимателя) и печатью (при наличии печати).
Оценка качества инъекционных и инфузионных растворов до стерилизации проводится по внешнему виду, отсутствию механических включений, значению pH, подлинности и количественному содержанию лекарственных средств, содержанию изотонирующих и стабилизирующих веществ.
Оценка качества инъекционных и инфузионных растворов после стерилизации проводится по внешнему виду, отсутствию механических включений, проверке номинального объѐма при розливе во флаконы, значению pH, допустимые погрешности при измерении которой приведены в таблице N 9 приложения N 3 к настоящим Правилам, подлинности и количественному содержанию лекарственных средств, отклонению от номинального объѐма, фиксированности укупорки, стерильности, пирогенности или содержанию бактериальных эндотоксинов.
При несоответствии одному из перечисленных требований растворы являются недоброкачественными.
-
Приказ Минздрава России от 26.10.2015 г. N 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность».
Контроль качества изготавливаемых и изготовленных лекарственных препаратов осуществляется посредством:
-
приѐмочного контроля;
-
письменного контроля;
-
опросного контроля;
-
органолептического контроля;
-
физического контроля;
-
химического контроля;
-
контроля при отпуске лекарственных препаратов.
Все изготовленные лекарственные препараты подлежат обязательному письменному, органолептическому контролю при отпуске. Раствор для инъекций контролируется на механические включения.
Письменный контроль:
Изготовленные лекарственные препараты, рецепты и требования, по которым изготовлены лекарственные препараты, заполненные паспорта письменного контроля передаются на проверку провизору, выполняющему контрольные функции при изготовлении и отпуске лекарственных препаратов.
Контроль заключается в проверке соответствия записей в паспорте письменного контроля назначениям в рецепте или требовании, правильности произведѐнных расчѐтов. При изготовлении лекарственных препаратов для инъекций и инфузий все стадии изготовления регистрируются в журнале регистрации результатов контроля отдельных стадий изготовления лекарственных препаратов для инъекций и инфузий.
В журнале регистрации результатов контроля отдельных стадий изготовления растворов для инъекций и инфузий указываются следующие сведения:
а) дата и порядковый номер проведения контроля; б) номер рецепта или требования;
в) наименование и взятое количество исходных средств (в том числе воды); г) наименование и объѐм изготовленного раствора;
д) подпись лица, изготовившего раствор;
е) фильтрование и фасовка (розлив) (указывается объѐм в миллилитрах и количество бутылок (флаконов));
ж) подпись лица, расфасовавшего раствор;
з) подпись лица, проводившего первичный контроль раствора на механические включения;
и) стерилизация (указывается температура, время «от» и «до», термотест, подпись лица, проводившего стерилизацию раствора на механические включения);
к) подпись лица, проводившего вторичный контроль раствора на механические включения;
л) номера анализов до и после стерилизации (указываются через дробь); м) количество ѐмкостей готовой продукции, поступившей для отпуска;
н) подпись лица, допустившего изготовленные лекарственные препараты к отпуску (допуск изготовленных растворов для инъекций и инфузий к отпуску осуществляет ответственное лицо, назначенное руководителем аптечной организации, или индивидуальный предприниматель, имеющий лицензию на фармацевтическую деятельность).
Журнал регистрации результатов контроля отдельных стадий изготовления растворов для инъекций и инфузий должен быть пронумерован, прошнурован и скреплѐн подписью руководителя аптечной организации (индивидуального предпринимателя) и
печатью (при наличии печати).
Опросный контроль:
Опросный контроль осуществляется выборочно и проводится после изготовления фармацевтом (провизором) не более пяти лекарственных форм.
При проведении опросного контроля провизором, осуществляющим контрольную функцию, называется первое входящее в состав лекарственного препарата лекарственное средство, а в лекарственных препаратах сложного состава указывается также его количество, после чего фармацевтом (провизором) указываются все иные используемые лекарственные средства и их количества.
Органолептический контроль:
Органолептический контроль является обязательным видом контроля и заключается в проверке лекарственного препарата по внешнему виду, запаху, однородности смешивания, отсутствию механических включений в жидких лекарственных формах. На вкус проверяются выборочно лекарственные формы, предназначенные для детей.
Физический контроль:
Физический контроль заключается в проверке общей массы или объѐма лекарственного препарата, количества и массы отдельных доз (не менее трѐх доз), входящих в лекарственный препарат,
Химический контроль:
Химический контроль заключается в оценке качества изготовления лекарственных препаратов по показателям:
-
качественный анализ: подлинность лекарственных средств;
-
количественный анализ: количественное определение лекарственных средств.
Для проведения химического контроля оборудуется специальное рабочее место, оснащѐнное необходимым оборудованием, приборами и реактивами, обеспеченное документами в области контроля качества и справочной литературой.
Контроль на механические включения:
До и после стерилизации стерильных растворов выполняется их контроль на механические включения.
Механическими включениями являются посторонние подвижные нерастворимые вещества, кроме пузырьков газа, случайно присутствующие в растворах лекарственных препаратов.
Одновременно должны проверяться объѐм растворов в ѐмкостях и качество их укупорки.
В процессе изготовления стерильные растворы должны подвергаться первичному и вторичному контролю на механические включения.
Первичный контроль осуществляется после фильтрования и фасовки изготовленного раствора.
При обнаружении механических включений раствор повторно фильтруется, вновь просматривается, укупоривается, маркируется и стерилизуется.
Растворы, изготовленные асептически, просматриваются один раз после фасовки или стерилизующего фильтрования.
Первичному и вторичному контролю подлежат 100% ѐмкостей с растворами.
Контроль растворов на отсутствие механических включений осуществляется провизором-технологом с соблюдением условий и техники контроля.
Для просмотра ѐмкостей должно быть специально оборудованное рабочее место, защищѐнное от попадания прямых солнечных лучей, допускается применение чѐрно- белого экрана и специальных устройств.
В зависимости от объѐма ѐмкости просматриваются одновременно от одной до пяти штук.
Контроль при отпуске:
Контролю при отпуске лекарственных препаратов подвергаются все изготовленные лекарственные препараты, в рамках которого проверяется соответствие:
а) упаковки лекарственного препарата физико-химическим свойствам, входящих в него лекарственных средств;
б) указанных в рецепте или требовании доз наркотических средств, психотропных, сильнодействующих веществ возрасту пациента;
в) реквизитов рецепта, требования сведениям, указанным на упаковке изготовленного лекарственного препарата;
г) маркировки лекарственного препарата.
-
-
Результаты органолептического, физического и химического контроля изготовленных лекарственных препаратов регистрируются в журнале регистрации результатов органолептического, физического и химического контроля лекарственных препаратов, изготовленных по рецептам, требованиям и в виде внутриаптечной заготовки, концентрированных растворов, тритураций, спирта этилового и фасовки лекарственных средств.
В данном журнале указываются следующие сведения: а) дата осуществления контроля и номер по порядку;
б) номер рецепта, требования, наименование медицинской организации, выдавшей их (при наличии);
в) номер серии лекарственного средства промышленного производства;
г) состав лекарственного средства: определяемое вещество или ион (указывается при физическом или химическом контроле лекарственных форм, изготовленных по рецептам);
д) результаты физического, органолептического, качественного контроля (каждый по шкале: положительный или отрицательный), химического контроля (качественное и количественное определение);
е) ФИО лица, изготовившего, расфасовавшего лекарственный препарат; ж) подпись лица, проверившего изготовленный лекарственный препарат;
з) заключение по результатам письменного контроля: удовлетворительно или неудовлетворительно.
Журнал регистрации результатов органолептического, физического и химического контроля лекарственных препаратов, изготовленных по рецептам, требованиям и в виде внутриаптечной заготовки, концентрированных растворов, тритураций, спирта этилового и фасовки лекарственных средств должен быть пронумерован, прошнурован и скреплѐн
подписью руководителя аптечной организации (индивидуального предпринимателя) и печатью (при наличии печати).
-
Приказ Минздрава России от 26.10.2015 г. N 751н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность»:
Этикетки на лекарственные препараты для парентерального введения с надписью:
«Для инъекций».
Этикетки имеют на белом фоне следующие сигнальные цвета в виде поля: для инъекций и инфузий - синий цвет.
На всех этикетках для оформления изготовленных лекарственных препаратов должны быть отпечатаны предупредительные надписи, соответствующие каждой лекарственной форме: р-р для инъекций и инфузий – «Стерильно».
Размеры этикеток определяются в соответствии с размерами посуды или другой упаковки, в которой отпускаются изготовленные лекарственные препараты.
На всех этикетках для оформления лекарственных препаратов, изготовленных для медицинских организаций, должно быть указано:
а) наименование медицинской организации и еѐ структурное подразделение (при необходимости);
б) наименование аптечной организации/ФИО индивидуального предпринимателя, имеющего лицензию на фармацевтическую деятельность;
в) местонахождение аптечной организации/фармацевтической деятельности индивидуального предпринимателя, имеющего лицензию на фармацевтическую деятельность;
г) ФИО пациента, для которого индивидуально изготовлен лекарственный препарат (при необходимости);
д) способ применения лекарственного препарата (внутреннее, наружное, для инъекций), вид лекарственной формы (глазные капли, мазь и т.д.);
е) дата изготовления лекарственного препарата;
ж) срок годности лекарственного препарата («Годен до
»);
з) подписи изготовившего, проверившего и отпустившего лекарственный препарат
(«Изготовил
, проверил
, отпустил
»);
и) номер анализа проверки лекарственного препарата;
к) состав лекарственного препарата (предусматривается пустое место для указания состава).
На этикетках лекарственных препаратов для инъекций и инфузий должен быть указан способ применения лекарственного препарата: «Внутривенно».
СИТУАЦИОННАЯ ЗАДАЧА K002508
-
Приѐмка товаров в аптеке осуществляется в соответствии с условиями, указанными в договоре поставки, а также требованиями «Инструкции о порядке приѐмки продукции производственно-технического назначения и товаров народного потребления по количеству» П-6 от 15.06.65 г. (с дополнениями и изменениями) и «Инструкции о
порядке приѐмки продукции производственно-технического назначения и товаров народного потребления по качеству» П-7 от 25.04.66 г. (с дополнениями и изменениями).
Основанием для приѐмки являются товарные документы – товарные накладные, товарно-транспортные накладные.
-
Поставщик при отгрузке товара выписывает аптечному учреждению:
-
расчѐтные документы – счета, платѐжные требования;
-
товарные документы – товарные накладные, товарно-транспортные
накладные;
-
налоговые документы – счета-фактуры;
-
сопроводительные документы, подтверждающие качество товара –
сопроводительный документ, сопроводительный лист, приложение по сертификатам, копии сертификатов соответствия и деклараций о соответствии;
-
документы согласования цены на ЖНВЛП – протокол согласования цен.
-
-
Требования к правилам хранения лекарственных средств утверждены приказом Минздравсоцразвития РФ от 23.08.2010 г. N 706 н «Об утверждении Правила хранения лекарственных средств» (в ред. от 28.12.2010 г.) и приказом Минздрава РФ от 31.08.2016 г. N 646 н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения».
Спиртовые настойки относятся к огнеопасным лекарственным средствам, а также к средствам, требующим защиты от улетучивания и высыхания.
Хранение огнеопасных лекарственных средств должно осуществляться отдельно от других лекарственных средств. В аптечных организациях выделяются изолированные помещения, оборудуемые средствами автоматической пожарной защиты и сигнализацией, для хранения огнеопасных лекарственных средств.
В аптечных организациях допускается хранение фармацевтических субстанций, обладающих легковоспламеняющимися и горючими свойствами, в объѐме до 10 кг вне помещений для хранения огнеопасных фармацевтических лекарственных средств во встроенных несгораемых шкафах.
Шкафы должны быть удалены от тепловыводящих поверхностей и проходов, с дверьми шириной не менее 0,7 м и высотой не менее 1,2 м. К ним должен быть организован свободный доступ. Не допускается хранение у отопительных приборов. Расстояние до нагревательного элемента должно быть не менее 1 м.
В помещениях для хранения лекарственные средства размещают в соответствии с требованиями нормативной документации, указанной на упаковке лекарственного препарата.
Температурный режим указан производителем в маркировке – при комнатной температуре или в прохладном месте (холодильник), в первичной и вторичной (потребительской) упаковке.
По способу применения (пустырника настойка – внутреннее, календулы настойка – наружное) указанные препараты хранят отдельно – на разных полках.
-
В соответствии с требованиями федерального закона от 12.04.2010 г. N 61- ФЗ (ред. от 03.07.2016 г.) «Об обращении лекарственных средств» и постановления Правительства РФ от 15 октября 2012 г. N 1043 «Об утверждении Положения о
федеральном государственном надзоре в сфере обращения лекарственных средств» государственная функция по организации и проведению проверок соответствия лекарственных средств, находящихся в обращении на территории РФ, установленным обязательным требованиям к их качеству возложена на Федеральную службу в сфере здравоохранения и еѐ территориальные органы.
Федеральный закон № 61-ФЗ «Об обращении лекарственных средств» даѐт определения фальсифицированным и недоброкачественным лекарственным средствам.
Фальсифицированное лекарственное средство – лекарственное средство, сопровождаемое ложной информацией о его составе и (или) производителе.
Недоброкачественное лекарственное средство – лекарственное средство, не соответствующее требованиям фармакопейной статьи либо в случае еѐ отсутствия требованиям нормативной документации или нормативного документа.
Все забракованные лекарственные средства подразделяют на Брак, Разбраковка, Фальсификат.
Брак – лекарственные средства которые не соответствуют требованиям нормативной документации по заявленным показателям.
Разбраковка – лекарственные средства, которые были ранее забракованы, но после проведения повторных исследований или после устранения причин несоответствия требованиям и повторного исследования были допущены к использованию и реализации.
Фальсификат – лекарственные средства, подлинность которых вызвала сомнение или в ходе исследования были признаны фальсифицированными.
-
Использование и реализация забракованных лекарственных средств на территории РФ запрещена.
При выявлении забракованных лекарственных препаратов в аптечном учреждении вся серия должна быть изъята из обращения и возвращена поставщику, в том числе выданная в отделение, но не израсходованная на дату забраковки.
При этом оформляется возвратная накладная на товар.
СИТУАЦИОННАЯ ЗАДАЧА K002509
-
Основанием для приѐмки являются товарные документы – товарные накладные, товарно-транспортные накладные.
Документы, поступающие вместе с товаром:
-
расчѐтные документы – счета, платѐжные требования;
-
товарные документы – товарные накладные, товарно-транспортные
накладные;
-
налоговые документы – счета-фактуры;
-
сопроводительные документы, подтверждающие качество товара –
сопроводительный документ, сопроводительный лист, приложение по сертификатам, копии сертификатов соответствия и деклараций о соответствии;
-
документы согласования цены на ЖНВЛП – протокол согласования цен.
-
-
Если товары доставляются транспортом поставщика, то приѐмка по количеству и качеству товаров производится в аптеке.
Для приѐмки товара по количеству и качеству по поступившей товарной накладной
распечатывается «Акт приѐмки товара», по которому необходимо сверять соответствие маркировки по показателям:
-
наименования товара,
-
наименования производителя,
-
дозировку или концентрацию,
-
количество лекарственных форм в упаковке или массу,
-
серию,
-
срок годности,
-
количество упаковок.
-
-
В карантинную зону помещены:
-
3 упаковки Бисопролола табл. 5 мг № 50, серия 197757 – фасовка и серия всех упаковок не соответствует указанным в товарной накладной;
-
1 упаковка череды травы фильтр-пакеты 1,5 г № 20, серия 140800 – серия одной упаковки не соответствует указанным в товарной накладной;
-
1 упаковка Левомицетин капли глазные флакон-капельница 10 мл № 1, серия 120623 – заводской брак.
-
-
Требования к организации в аптеке карантинной зоны утверждены приказом Минздравсоцразвития РФ от 23.08.2010 г. N 706 н «Об утверждении Правила хранения лекарственных средств» (в ред. от 28.12.2010 г.) и приказом Минздрава РФ от 31.08.2016 г. N 646 н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения».
Выявленные при проведении приѐмочного контроля лекарственные средства, не соответствующих сопроводительным документам, должны храниться отдельно от других групп лекарственных средств в специально выделенной и обозначенной (карантинной) зоне.
-
По результатам приѐмочного контроля в аптеку приняты следующие товары: череды трава фильтр-пакеты 1,5 г № 20, серия 140815 – 4 упаковки; Левомицетин капли глазные флакон-капельница 10 мл № 1, серия 120623 – 9 упаковок.
Требования к правилам хранения лекарственных средств утверждены приказом Минздравсоцразвития РФ от 23.08.2010 г. N 706 н «Об утверждении Правила хранения лекарственных средств» (в ред. от 28.12.2010 г.) и приказом Минздрава РФ от 31.08.2016 г. N 646 н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения».
В помещениях для хранения лекарственные средства размещают в соответствии с требованиями нормативной документации, указанной на упаковке лекарственного препарата.
С учѐтом способа применения и физико-химических свойств (температурный режим, указанный производителем) капли глазные размещаются отдельно от других лекарственных средств – отдельная полка в шкафу или холодильнике.
Череды трава хранится на стеллаже или в шкафу для хранения лекарственных растительных препаратов отдельно от плодов и семян; сборов; препаратов, содержащих эфирно-масличное, а также ядовитое и сильнодействующее сырьѐ.
-
Все товары, поступающие в аптеку, должны иметь сопроводительные документы, подтверждающие их качество – сопроводительный документ, сопроводительный лист, приложение по сертификатам, копии сертификатов соответствия и деклараций о соответствии.
Для подтверждения качества товара может быть предъявлена копия указанных документов, заверенная подписью специалиста аптеки и печатью аптеки.
-
Поставщик при отгрузке товара выписывает аптечному учреждению:
-
расчѐтные документы – счета, платѐжные требования;
-
товарные документы – товарные накладные, товарно-транспортные накладные;
-
налоговые документы – счета-фактуры;
-
сопроводительные документы, подтверждающие качество товара – сопроводительный документ, сопроводительный лист, приложение по сертификатам, копии сертификатов соответствия и деклараций о соответствии;
-
документы согласования цены на ЖНВЛП – протокол согласования цен.
-
-
Требования к правилам хранения лекарственных средств утверждены приказом Минздравсоцразвития РФ от 23.08.2010 г. N 706 н «Об утверждении Правила хранения лекарственных средств» (в ред. от 28.12.2010 г.) и приказом Минздрава РФ от 31.08.2016 г. N 646 н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения».
Хранение лекарственных средств, требующих защиты от воздействия повышенной температуры (термолабильные лекарственные средства), организации и индивидуальные предприниматели должны осуществлять в соответствии с температурным режимом, указанным на первичной и вторичной (потребительской) упаковке лекарственного средства в соответствии с требованиями нормативной документации.
Мазь с метилурацилом должна храниться в холодильнике при температуре от 8 °С до 15 °С.
-
В соответствии с ГФ XIII изд. (ОФС 1.1.0015.15 «Хранение лекарственных средств») в аптеках устанавливаются следующие температурные режимы:
-
Обеспечение холодного места подразумевает хранение лекарственных средств в холодильнике при температуре от 2 °С до 8 °С, не допуская замораживания.
-
Хранение в прохладном месте подразумевает хранение лекарственных средств при температуре от 8 °С до 15 °С.
-
Хранение при комнатной температуре подразумевает температурный режим от 15 °С до 25 °С или, в зависимости от климатических условий, до 30 °С.
-
-
Описание лекарственных препаратов можно найти в «Инструкции по медицинскому применению препарата».
При проведении приѐмочного контроля показатель «Описание» может контролироваться только у лекарственных средств, имеющих прозрачную первичную упаковку.
Мазь метилурациловая герметично упаковывается в тубу, поэтому при приѐмке нельзя оценить соответствие данного показателя указанному в инструкции.
СИТУАЦИОННАЯ ЗАДАЧА K002511
-
Руководитель аптечной организации самостоятельно назначает ответственных за приѐмочный контроль сотрудников из числа фармацевтических работников организации (провизоров или фармацевтов), что оформляется распорядительным документом по аптеке.
К приѐмке любых товаров аптечного ассортимента допускаются сотрудники, указанные в данном приказе, поэтому технический работник не имеет права принимать участие в приѐмке.
-
Поставщик при отгрузке товара выписывает аптечному учреждению:
-
расчѐтные документы – счета, платѐжные требования;
-
товарные документы – товарные накладные, товарно-транспортные
накладные;
-
налоговые документы – счета-фактуры;
-
сопроводительные документы, подтверждающие качество товара –
сопроводительный документ, сопроводительный лист, приложение по сертификатам, копии сертификатов соответствия и деклараций о соответствии.
-
Салфетки и контейнеры относятся к медицинским изделиям.
Требования к правилам хранения медицинских изделий регламентированы приказом Минздрава РФ от 13.11.1996 г. N 377 (ред. от 23.08.2010 г.) «Об утверждении Инструкции по организации хранения в аптечных учреждениях различных групп лекарственных средств и изделий медицинского назначения».
-
Изделия из пластмасс следует хранить в вентилируемом тѐмном помещении, на расстоянии не менее 1 м от отопительных систем. В помещении не должно быть открытого огня, паров летучих веществ. Электроприборы, арматура и выключатели должны быть изготовлены в противоискровом (противопожарном) исполнении. В помещении, где хранятся целлофановые, целлулоидные, аминопластовые изделия, следует поддерживать относительную влажность воздуха не выше 65%.
Перевязочные средства хранят в сухом проветриваемом помещении в шкафах, ящиках, на стеллажах и поддонах. Шкафы, где находятся перевязочные материалы, периодически протирают 0,2% раствором хлорамина или другими разрешѐнными к применению дезинфекционными средствами.
Стерильный перевязочный материал (бинты, марлевые салфетки, вата) хранятся в заводской упаковке. Запрещается их хранение в первичной вскрытой упаковке.
Нестерильный перевязочный материал хранят отдельно от стерильного.
-
В соответствии с приказом Минздравсоцразвития РФ от 23.08.2010 г. № 706н «Об утверждении правил хранения лекарственных средств» помещения для хранения должны быть оснащены приборами для регистрации параметров воздуха (термометрами, гигрометрами (электронными гигрометрами) или психрометрами).
-
-
Измерительные части этих приборов должны размещаться на расстоянии не менее
3 м от дверей, окон и отопительных приборов. Приборы и (или) части приборов, с которых производится визуальное считывание показаний, должны располагаться в доступном для персонала месте на высоте 1,5–1,7 м от пола.
Показания этих приборов должны ежедневно регистрироваться в специальном
журнале (карте) регистрации на бумажном носителе или в электронном виде с архивацией (для электронных гигрометров), который ведѐтся ответственным лицом.
Журнал (карта) регистрации хранится в течение одного года, не считая текущего.
Контролирующие приборы должны быть сертифицированы, калиброваны и подвергаться поверке в установленном порядке.
СИТУАЦИОННАЯ ЗАДАЧА K002540
-
Анализ показывает:
-
компоненты прописи совместимы;
-
препарат должен быть выписан на бланке рецепта формы № 107-000/у;
-
веществ, подлежащих ПКУ и НЕО нет;
-
проверка доз не требуется. Препарат изготавливать можно.
-
-
Оборотная сторона ППК Листьев мяты 3,0
КВП листьев мяты – 2,4
Воды очищенной 80 + 3,0×2,4=87,2 мл Сиропа сахарного 5 мл
Лицевая сторона ППК
Дата
№ рецепта
Foliorum Menthae piperitae 3,0 Aquae purificatae 87,2
Sirupi simplicis 5 ml Vобщ – 85 мл Приготовил (подпись) Проверил (подпись)
-
Листья мяты измельчают до размера не более 5 мм, отсеивают от пыли, отвешивают 3,0.
Помещают в прогретую инфундирку, заливают 87,2 мл воды очищенной, накрывают крышкой и настаивают на кипящей водяной бане 15 мин. не перемешивая. Настаивают при комнатной температуре 45 мин.
Настой процеживают через двойной слой марли с подложенным комочком ваты, переносят в мерный цилиндр, доводят водой до 80 мл.
Полученный настой переносят во флакон для отпуска, добавляют 5 мл сиропа сахарного.
-
Флакон укупоривают плотно пластмассовой пробкой с навинчивающейся крышкой. Наклеивают номер рецепта и этикетку.
На этикетках для оформления лекарственных препаратов, изготовленных для населения, должно быть указано:
а) наименование аптечной организации, ФИО индивидуального предпринимателя, имеющего лицензию на фармацевтическую деятельность;
б) местонахождение аптечной организации или место фармацевтической деятельности индивидуального предпринимателя;
день
в) номер рецепта (присваивается в аптеке); г) ФИО пациента;
д) «Внутреннее», Микстура»
е) подробное описание способа применения (для микстур: «по еды»);
ж) дата изготовления лекарственного препарата;
ложке
раз в
з) срок годности лекарственного препарата («Годен до и) цена лекарственного препарата;
»);
к) предостережение «Хранить в недоступном для детей месте».
Для микстур обязательны дополнительные этикетки «Перед употреблением взбалтывать», «Хранить в прохладном и защищѐнном от света месте».
Текст этикеток должен быть напечатан типографским способом на русском языке. Срок хранения – не более 2 суток.
Оформление согласно требованиям приказа № 751н от 26.10.2015 г.
-
Анализ документации. Имеющийся рецепт, паспорт письменного контроля и номер лекарственной формы соответствуют.
Ингредиенты совместимы, расчѐты сделаны верно. Объѐм флакона соответствует объѐму лекарственной формы. Флакон укупорен герметично. Этикетка соответствует способу применения.
Органолептический контроль. Светло-жѐлтая жидкость с характерным запахом.
Механические включения отсутствуют.
Объѐм лекарственной формы 85±2,5 мл, что соответствует нормам допустимых отклонений (±3%) по приказу МЗ РФ № 751н.
СИТУАЦИОННАЯ ЗАДАЧА K002541
-
Анализ показывает:
-
компоненты прописи совместимы;
-
препарат должен быть выписан на бланке рецепта формы № 107-000/у;
-
веществ, подлежащих ПКУ и НЕО нет;
-
проверка доз:
Кофеина-бензоата натрия
ВРД = 0,5; Число приѐмов: 75/15=5; РД = 0,000/15=0,007 ВСД = 1,5; СД = 0,007×3=0,02
Дозы не завышены.
Препарат изготавливать можно.
-
-
Оборотная сторона ППК: Травы пустырника 70/10=7,0. КВП травы пустырника – 2,0.
Воды очищенной 70 + 7,0×2,0=84 мл.
Кофеина-бензоата натрия 0,1.
Натрия бромида 0,2.
Расчѐт содержания в микстуре твѐрдых лв: 0,1+0,2=0,3
0,3 - 75 мл
х -100 мл
х= 0,4% (меньше 3%, прирост объѐма не учитываем) Настойки валерианы 5 мл
Лицевая сторона ППК
Дата
№ рецепта
Herbae Leonuri 7,0 Aquae purificatae 84 ml
Coffeini- natrii benzoatis 0,1 Natrii bromidi 0,2
Tincturae Valerianae 5 ml Vобщ –75 мл
Приготовил (подпись) Проверил (подпись)
-
Траву пустырника измельчают до частиц не более 5 мм, отсеивают от пыли, отвешивают 7,0. Помещают в прогретую инфундирку, заливают 84 мл воды очищенной, накрывают крышкой и настаивают на кипящей водяной бане 15 мин. не перемешивая, настаивают при комнатной температуре 45 минут.
Настой процеживают через двойной слой марли с подложенным комочком ваты, переносят в мерный цилиндр, доводят водой до 70 мл.
Полученный настой переносят в подставку и растворяют в нѐм 0,1 кофеина- бензоата натрия и 0,2 натрия бромида, фильтруют во флакон для отпуска, добавляют 5 мл настойки валерианы.
-
Флакон укупоривают плотно пластмассовой пробкой с навинчивающейся крышкой.
Наклеивают номер рецепта и этикетку.
На этикетках для оформления лекарственных препаратов, изготовленных для населения, должно быть указано:
а) наименование аптечной организации, ФИО индивидуального предпринимателя, имеющего лицензию на фармацевтическую деятельность;
б) местонахождение аптечной организации или место фармацевтической деятельности индивидуального предпринимателя;
в) номер рецепта (присваивается в аптеке); г) ФИО пациента;
д) «Внутреннее», Микстура»;
день
е) подробное описание способа применения (для микстур: «по еды»);
ж) дата изготовления лекарственного препарата;
ложке
раз в
з) срок годности лекарственного препарата («Годен до и) цена лекарственного препарата;
»);
к) предостережение «Хранить в недоступном для детей месте».
Для микстур обязательны дополнительные этикетки «Перед употреблением взбалтывать», «Хранить в прохладном и защищѐнном от света месте».
Текст этикеток должен быть напечатан типографским способом на русском языке. Срок хранения – не более 2 суток.
Оформление согласно требованиям приказа № 751н от 26.10.2015 г.
-
Анализ документации. Имеющийся рецепт, паспорт письменного контроля и номер лекарственной формы соответствуют.
Ингредиенты совместимы, дозы не превышены, расчѐты сделаны верно. Объѐм флакона соответствует объѐму лекарственной формы. Флакон укупорен герметично. Этикетка соответствует способу применения.
Органолептический контроль. Светло-коричневая жидкость с характерным запахом. Механические включения отсутствуют.
Объѐм лекарственной формы 75±2,3 мл, что соответствует нормам допустимых отклонений (±3%) по приказу МЗ РФ № 751н.
СИТУАЦИОННАЯ ЗАДАЧА K002543
-
Анализ показывает:
-
компоненты прописи совместимы;
-
препарат должен быть выписан на бланке рецепта формы № 107-000/у;
-
веществ, подлежащих ПКУ и НЕО нет;
-
проверка доз не требуется. Препарат изготавливать можно.
-
-
Оборотная сторона:
Расчѐт корней алтея: 180:20=9,0. Красх=1,3 С учѐтом Красх.: 9×1,3 = 11,7 г.
Воды очищенной: 180×1,3 = 234 мл Натрия бензоата: 4,0 г
Прирост объѐма (КУО = 0,6 мл/г) = 0,6 мл/г × 4,0 = 2,4 мл
Допустимые отклонения в объѐме (+/- 2%) = 180 мл × 2%/100% = 3,6 мл больше 2,4
мл
Следовательно, прирост объѐма укладывается в допустимые отклонения Лицевая сторона:
Дата
№ рецепта
Radicis Althaeae 11,7 Aquae purificatae 234 ml Natrii benzoatis 4,0
Vобщ – 180 мл Приготовил (подпись) Проверил (подпись)
-
Поскольку в рецепте не указано количество корня алтея, настой готовят 5% концентрации.
Учитывая особенности сырья и то что слизь алтея не отжимают из сырья, при изготовлении используют расходный коэффициент для сырья и воды, равный 1,3.
Берут 11,7 г сырья и 234 мл воды очищенной. Настаивание проводят в течение 30 минут при комнатной температуре при периодическом перемешивании.
После настаивания извлечение фильтруют, не отжимая сырья, через двойной слой марли с подложенным ватным тампоном в мерный цилиндр и промывают сырьѐ водой очищенной, доводя объѐм извлечения до 180 мл.
Отвешивают 4,0 г натрия бензоата, растворяют в профильтрованном настое, хорошо перемешивают, после чего ещѐ раз фильтруют во флакон для отпуска.
-
Флакон оранжевого стекла укупоривают плотно пластмассовой пробкой с навинчивающейся крышкой. Наклеивают отдельный рецептурный номер и этикетку.
На этикетках для оформления лекарственных препаратов, изготовленных для населения, должно быть указано:
а) наименование аптечной организации, ФИО индивидуального предпринимателя, имеющего лицензию на фармацевтическую деятельность;
б) местонахождение аптечной организации или место фармацевтической деятельности индивидуального предпринимателя;
в) номер рецепта (присваивается в аптеке); г) ФИО пациента;
д) наименование или состав лекарственного препарата;
е) способ применения лекарственного препарата («Внутреннее»), вид лекарственной формы («Микстура»);
день
ж) подробное описание способа применения (для микстур: «по еды»);
з) дата изготовления лекарственного препарата;
ложке
раз в
и) срок годности лекарственного препарата («Годен до к) цена лекарственного препарата;
»);
л) предостережение «Хранить в недоступном для детей месте».
Для микстур обязательны дополнительные этикетки «Перед употреблением взбалтывать», «Хранить в прохладном и защищѐнном от света месте».
Текст этикеток должен быть напечатан типографским способом на русском языке.
Состав лекарственного препарата пишется от руки или наносится штампом.
Срок хранения – не более 2 суток.
Оформление согласно требованиям приказа № 751н от 26.10.2015 г.
-
Анализ документации. Имеющийся рецепт, паспорт письменного контроля и номер лекарственной формы соответствуют.
Ингредиенты совместимы, расчѐты сделаны верно. Правильность упаковки и оформления.
Объѐм флакона оранжевого стекла соответствует объѐму лекарственной формы, пробка нужного качества обеспечивает герметичность укупорки.
Органолептический контроль. Молочно-белая жидкость со слабым запахом.
Объѐм лекарственной формы 180 ± 3,6 мл, что соответствует нормам допустимых отклонений (± 2%) по приказу МЗ РФ № 751н.
СИТУАЦИОННАЯ ЗАДАЧА K002544
-
Анализ показывает:
-
выписан раствор труднорастворимого лекарственного вещества с особым случаем растворения;
-
препарат должен быть выписан на бланке рецепта формы № 107-000/у;
-
веществ, подлежащих ПКУ и НЕО нет;
-
проверка доз не требуется, так как раствор для наружного применения. Препарат изготавливать можно.
-
-
Оборотная сторона: Фурацилина: 0,04 г Натрия хлорида: 1,8 г Воды очищенной: 200 мл Лицевая сторона:
Дата
№ рецепта
0,9%.
Aquae purificatae 200 ml Natrii chloridi 1,8
Furacilini 0,04
Vобщ –200 мл Приготовил (подпись) Проверил (подпись)
-
Растворы фурацилина готовят на изотоническом растворе натрия хлорида
Растворимость фурацилина в воде равна 1:4200, поэтому для ускорения этого
процесса используют нагревание.
В подставку отмеривают 200 мл воды очищенной, на весах отвешивают 1,8 г натрия хлорида и растворяют в подставке с водой. Затем на отдельных (для красящих веществ) весах отвешивают 0,04 г фурацилина и добавляют к 0,9% раствору натрия хлорида.
Нагревают на водяной бане для растворения фурацилина. После охлаждают раствор и фильтруют во флакон для отпуска.
Проверяют на отсутствие механических примесей, укупоривают и оформляют к отпуску.
-
Флакон оранжевого стекла укупоривают плотно пластмассовой пробкой с навинчивающейся крышкой. Наклеивают номер рецепта и этикетку.
На этикетках для оформления лекарственных препаратов, изготовленных для населения, должно быть указано:
а) наименование аптечной организации, ФИО индивидуального предпринимателя, имеющего лицензию на фармацевтическую деятельность;
б) местонахождение аптечной организации или место фармацевтической деятельности индивидуального предпринимателя;
в) номер рецепта (присваивается в аптеке); г) ФИО пациента;
д) наименование или состав лекарственного препарата;
е) способ применения лекарственного препарата («Наружное»);
ж) подробное описание способа применения (для полоскания горла); з) дата изготовления лекарственного препарата;
и) срок годности лекарственного препарата («Годен до к) цена лекарственного препарата;
»);
л) предостережение «Хранить в недоступном для детей месте».
Текст этикеток должен быть напечатан типографским способом на русском языке. Состав лекарственного препарата пишется от руки или наносится штампом.
Срок хранения – не более 2 суток.
Оформление согласно требованиям приказа № 751н от 26.10.2015 г.
-
Анализ документации. Имеющийся рецепт, паспорт письменного контроля и номер лекарственной формы соответствуют, расчѐты сделаны верно, ППК выписан верно.
Правильность упаковки и оформления. Объѐм флакона оранжевого стекла соответствует объѐму лекарственной формы. Раствор укупорен плотно.
Органолептический контроль. Прозрачный жѐлтый раствор, без запаха горького
вкуса.
Механические включения отсутствуют.
Объѐм раствора 200 ± 2 мл, что соответствует нормам допустимых отклонений (±
1%) по приказу МЗ РФ № 751н.
СИТУАЦИОННАЯ ЗАДАЧА K002585
-
Форма рецептурных бланков № 107/у предназначена для выписывания большинства лекарственных средств (кроме отнесѐнных к наркотическим и психотропным, списка II, психотропным списка III, оборот которых ограничен, и тех медикаментов, которые отпускаются льготно или бесплатно).
Принято придерживаться следующих правил его заполнения:
Рецепт выписывается на латинском языке, разборчиво, чѐтко, чернилами или шариковой ручкой.
В рецепте обязательно указываются международные, непатентованные названия лекарственных средств.
Синонимическую замену выписанных медикаментов производит фармацевт в аптеке. Исправления в рецепте заверяются подписью и личной печатью врача!
На одном рецептурном бланке № 107/у можно выписать не более 2 лекарственных средств.
При написании рецепта ИО больного может быть указано сокращѐнно и допускаются исключительно общепринятые сокращения обозначений и слов.
Обозначения твѐрдых и мягких веществ указывается в граммах (0,1; 0,01; 0,001; 0,0001; 0,00001 и т.д.), жидких лекарственных средств в мл или каплях в правой части рецепта.
Количество капель обозначают римской цифрой, например, guttas V (пять капель).
Способ применения медикаментов указывается на русском или национальных языках.
Подпись врача должна быть заверена личной печатью.
Рецепт действителен в течение 2 месяцев.
-
Статья 58.1. Предметно-количественный учѐт лекарственных средств для медицинского применения (введена Федеральным законом от 25.12.2012 г. N 262-ФЗ).
-
Перечень лекарственных средств для медицинского применения, подлежащих предметно-количественному учѐту, утверждается уполномоченным федеральным органом исполнительной власти.
-
Порядок включения лекарственных средств для медицинского применения в перечень лекарственных средств для медицинского применения, подлежащих предметно- количественному учѐту, устанавливается уполномоченным федеральным органом исполнительной власти по согласованию с федеральным органом исполнительной власти, уполномоченным в сфере внутренних дел.
(в ред. Федерального закона от 03.07.2016 г. N 305-ФЗ) (см. текст в предыдущей редакции)
-
Предметно-количественный учѐт лекарственных средств для медицинского применения ведут производители лекарственных средств, организации оптовой торговли лекарственными средствами, аптечные организации, индивидуальные предприниматели, имеющие лицензию на фармацевтическую деятельность или лицензию на медицинскую деятельность, и медицинские организации, осуществляющие обращение лекарственных средств для медицинского применения, путѐм регистрации любых связанных с их обращением операций, при которых изменяется их количество и (или) состояние, в специальных журналах учѐта операций, связанных с обращением лекарственных средств для медицинского применения (далее - специальные журналы).
-
Правила регистрации операций, связанных с обращением лекарственных средств для медицинского применения, включѐнных в перечень лекарственных средств для медицинского применения, подлежащих предметно-количественному учѐту, в специальных журналах и правила ведения и хранения специальных журналов утверждаются уполномоченным федеральным органом исполнительной власти.
-
Контроль за соблюдением правил регистрации операций, связанных с обращением лекарственных средств для медицинского применения, включѐнных в перечень лекарственных средств для медицинского применения, подлежащих предметно- количественному учѐту, в специальных журналах, а также за соблюдением правил ведения и хранения специальных журналов возлагается на уполномоченные федеральные органы исполнительной власти и органы исполнительной власти субъектов Российской Федерации, осуществляющие лицензирование производства лекарственных средств, фармацевтической деятельности и медицинской деятельности, и осуществляется в рамках лицензионного контроля.
-
Цена на лекарственные средства, изготавливаемых в аптеках, формируется
из:
-
стоимости ингредиентов по розничным ценам,
-
стоимости аптечной посуды,
-
тарифов на изготовление (определение тарифов на изготовление лекарств,
внутриаптечную заготовку и фасовку производят на основании методических рекомендаций, утверждѐнных МЗ РФ или местных органов управления аптечной службой,
кроме того, если в уставе аптеки есть запись о том, что в аптечном учреждении разработаны тарифы на изготовление лекарственных форм аптеки, то директор аптеки имеет право утверждать свои тарифы).

Торговая надбавка и тарифы не покрывают всех расходов по изготовлению ЛП и, поэтому, в аптеках, где производство ещѐ осталось, необходимо постоянно корректировать тарифы, а убыточность этого вида деятельности компенсировать доходами по реализации готовых ЛП.
-
-
Предельно допустимое количество отдельных наркотических и психотропных лекарственных препаратов для выписывания на один рецепт.
При выписывании рецепта запрещается превышать предельно допустимое количество лекарственного препарата для выписывания на один рецепт, за исключением:
Количество выписываемых наркотических и психотропных лекарственных препаратов списков II и III Перечня, иных лекарственных препаратов, подлежащих предметно-количественному учѐту, при оказании пациентам паллиативной медицинской помощи может быть увеличено не более чем в 2 раза по сравнению с предельно допустимым количеством лекарственных препаратов для выписывания на один рецепт, или рекомендованным количеством лекарственных препаратов для выписывания на один рецепт.
Комбинированные лекарственные препараты, содержащие кодеин (соли кодеина).
Все лекарственные формы не более 0,2 г, согласно приказу Минздрава России от 20 декабря 2012 г. № 1175н.
-
Хранение рецептурных бланков.
В каждой медицинской организации приказом руководителя назначается лицо, ответственное за хранение и учѐт всех видов рецептурных бланков.
Рецептурные бланки, подлежащие учѐту, хранятся ответственным лицом, назначенным руководителем медицинской организации, под замком в металлическом шкафу (сейфе) или металлическом ящике.
Индивидуальный предприниматель, имеющий лицензию на медицинскую деятельность, хранит рецептурные бланки, подлежащие учѐту, под замком в металлическом шкафу (сейфе) или металлическом ящике.
Постоянно действующая комиссия, создаваемая в медицинской организации, проверяет состояние хранения, учѐта, фактическое наличие и расход рецептурных бланков, подлежащих учѐту, один раз в квартал.
В случае несовпадения книжного остатка рецептурных бланков, подлежащих учѐту, с фактическим наличием, лицо, ответственное за хранение и учѐт рецептурных
бланков, несѐт ответственность, предусмотренную законодательством Российской Федерации.
Рецептурные бланки, подлежащие учѐту, выдаются медицинским работникам, имеющим приказ Минздрава РФ от 20.12.2012г. N 1175н – «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учѐта и хранения».
Действующая последняя редакция от 30.06.2015 г. – с изменениями и дополнениями, вступившими в силу с 01.01.2016 г., зарегистрировано в Минюсте РФ 25 июня 2013 г. N 28883, право выписывания рецептов, по распоряжению главного врача или его заместителя.
Полученные рецептурные бланки, подлежащие учѐту, хранятся медицинскими работниками в помещениях, обеспечивающих их сохранность.
Хранение специальных рецептурных бланков, на наркотическое средство и психотропное вещество, и выдача указанных рецептурных бланков медицинскому работнику, осуществляется в соответствии с приказом Министерства здравоохранения Российской Федерации от 1 августа 2012 г. N 54н «Об утверждении формы бланков рецептов, содержащих назначение наркотических средств или психотропных веществ, порядка их изготовления, распределения, регистрации, учѐта и хранения, а также правил оформления».
СИТУАЦИОННАЯ ЗАДАЧА K002586
-
Эфедрин относится к группе адреномиметиков непрямого действия (симпатомиметик).
-
В основе механизма действия Эфедрина лежит способность вызывать высвобождение норадреналина из резервов в адренергических системах и тормозить обратный захват норадреналина, в связи с чем усиливаются эффекты раздражения адренергических нервов, а также потенцируется действие вводимых извне катехоламинов. К Эфедрину возникает быстрое привыкание (тахифилаксия) при повторном введении (через 10-30 минут), которое связано с прогрессирующим снижением запасов в
варикозных утолщениях норадреналина.
-
Rp.: Ephedrini hydrochloridi 0,6 Sol. Procaini (Novocaini) 1% 100 ml Dimedroli 1,0
Acidi ascorbinici 2,0
Misce. Da. Signa: по 10 мл на ингаляцию.
Норма отпуска эфедрина гидрохлорида 0,6 г не превышена, он находится в аптеке на ПКУ.
Оборотная сторона рецепта
Ephedrini hydrochloridi 0,6 (шесть дециграммов) Дата
Выдал: Получил:
Паспорт письменного контроля Оборотная сторона
% твѐрдых веществ = 0,6+1,0+1,0+2,0/100×100% =4,6%, что больше 3%
Следовательно, необходимо учесть прирост объѐма при растворении твѐрдых веществ.
КУО эфедрина г/х=0,84 мл/г КУО новокаина = 0,81 мл/г КУО димедрола=0,86 мл/г
КУО кислоты аскорбиновой=0,61 мл/г
Воды очищенной: 100 мл-(0,6×0,84 мл/г) - (1,0×0,81 мл/г) - (1,0×0,86 мл/г) - (2,0×0,61 мл/г) = 96,61 мл
Лицевая сторона Дата
№ рецепта
Aquae purifcatae 96,1 ml Ephedrini hydrochloridi 0,6
Procaini (Novocaini) 1,0
Dimedroli 1,0
Acidi ascorbinici 2,0 Общий объѐм 100 мл Приготовил Проверил
Отпустил
В подставку отмеривают 96,1 мл воды очищенной. Эфедрина гидрохлорид 0,6 г отвешивает провизор-технолог в присутствии изготавливающего лекарственный препарат, о чѐм делается запись на оборотной стороне рецепта. Растворяют его в отмеренном объѐме воды очищенной. Затем последовательно в этой же подставке растворяют 1,0 г новокаина, 1,0 г димедрола и 2,0 г кислоты аскорбиновой, перемешивают и фильтруют через промытый ватный тампон во флакон для отпуска тѐмного стекла (ингредиенты прописи светочувствительны).
Этикетки: «Наружное», «Хранить в прохладном, защищѐнном от света месте»,
«Хранить в недоступном для детей месте», выписывается «Сигнатура».
До отпуска больному лекарственный препарат хранится в запирающемся шкафу.
-
Оценка качества и сроки хранения в аптеке осуществляется в соответствии с приказом М3 РФ № 214 от 16.07.97 г. и приказом МЗ РФ № 751н от 26.10 2015 г.
Виды внутриаптечного контроля обязательные для данного лекарственного препарата: письменный, органолептический, контроль при отпуске. К целесообразным видам контроля относятся опросный и физический.
-
Все поступившие в аптеку рецепты проверяются на правильность их написания и оформления, и регистрируются:
а) в рецептурном журнале;
б) в квитанционном комплекте, а именно по корешкам квитанционного комплекта. Здесь учитывается количество и стоимость амбулаторных рецептов.
Ежедневно эти данные в конце смены или рабочего дня переносятся в «Журнал учѐта рецептуры».
СИТУАЦИОННАЯ ЗАДАЧА K002587
-
Действия провизора по отпуску Нозепама верны.
Нозепам является психотропным веществом, внесѐнным в список III Перечня и выписываться должен на рецептурном бланке формы N 148-000/у-88.
Сам рецептурный бланк формы № 148-000/у-88 должен иметь серию и номер, штамп МО с указанием его наименования, адреса и телефона.
Должны быть указаны ФИО полностью и возраст больного, адрес или номер медицинской карты пациента, получающего медицинскую помощь в амбулаторных условиях, ФИО врача полностью.
Рецепт подписывается врачом и заверяется его личной печатью. Дополнительно рецепт заверяется печатью МО «Для рецептов». На одном бланке разрешается выписывать только одно МНН.
Отпуск больным психотропных веществ, внесѐнных в Список III Перечня, осуществляется фармацевтическими работниками аптечных учреждений (организаций), имеющими на это право в соответствии с приказом МЗ РФ от 13 мая 2005 г. N 330.
Психотропные вещества, внесѐнные в Список III Перечня отпускаются при предъявлении рецепта, выписанного на рецептурном бланке формы N 148-000/у-88.
При отпуске психотропных веществ, внесѐнных в Список III Перечня, больным вместо рецепта выдаѐтся сигнатура с жѐлтой полосой в верхней части и надписью чѐрным шрифтом на ней «Сигнатура».
-
Нозепам подлежит ПКУ, так как включѐн в Перечень наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации
(утв. постановлением Правительства РФ от 30 июня 1998 г. N 681) (Список III) и хранится в запирающемся в деревянном или металлическом шкафу.
Регистрация операций, связанных с обращением лекарственных средств, являющихся наркотическими средствами, психотропными веществами или их прекурсорами, включѐнными в списки II, III, IV перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, осуществляется субъектами обращения лекарственных средств в специальных журналах. Страницы должны быть пронумерованы, прошнурованы, опечатаны и заверены подписью руководителя. Журнал заводится на 1 год.
-
Фармакологическое действие – анксиолитическое, седативное, снотворное. Побочные действия: сонливость (обычно в первые дни лечения), вялость,
головокружение, повышенная утомляемость, головная боль, нарушение памяти, мышечная слабость, сухость во рту, тошнота, диспептические явления, лейкопения, нарушение функции печени (включая желтуху), аллергические реакции, привыкание, лекарственная зависимость, синдром отмены.
-
Анксиолитическое средство (транквилизатор) бензодиазепинового ряда. Оказывает седативно-снотворное, противосудорожное и центральное
миорелаксирующее действие.
Усиливает ингибирующее действие ГАМК (медиатор пре- и постсинаптического торможения во всех отделах ЦНС) на передачу нервных импульсов.
Стимулирует бензодиазепиновые рецепторы, расположенные в аллостерическом центре постсинаптических ГАМК-рецепторов восходящей активирующей ретикулярной формации ствола мозга и вставочных нейронов боковых рогов спинного мозга.
-
В настоящее время аналогами препарата «Нозепам» являются следующие медикаменты:
«Элениум», «Диазепам», «Оксазепам», «Феназепам».
Так же, как и рассматриваемый транквилизатор, все перечисленные средства отпускаются в аптеках только по рецепту врача.
Показаниями к применению Нозепама являются следующие состояния:
-
неврозы;
-
психовегетативные расстройства;
-
реактивные депрессии (препарат используют в составе комплексного лечения).
СИТУАЦИОННАЯ ЗАДАЧА K002588
-
Права граждан на получение социальной помощи регламентированы Федеральным законом от 17.07.1999 г. № 178-ФЗ «О государственной социальной помощи» (с изменениями).
Государственная социальная помощь – предоставление малоимущим семьям, малоимущим одиноко проживающим гражданам, а также иным категориям граждан, указанным в Федеральном законе № 178, социальных пособий, социальных доплат к пенсии, субсидий, социальных услуг и жизненно необходимых товаров.
Набор социальных услуг – перечень социальных услуг, предоставляемых отдельным категориям граждан в соответствии с Федеральным законом № 178.
Набор социальных услуг состоит из 3 частей:
обеспечение лекарственными препаратами, санаторно-курортное лечение и проезд на пригородном железнодорожном транспорте.
Право на получение государственной социальной помощи в виде набора социальных услуг имеют следующие категории граждан:
-
инвалиды войны;
-
участники Великой Отечественной войны;
-
ветераны боевых действий;
-
не воевавшие в действующей армии военнослужащие, служившие в период с 22 июня 1941 года по 3 сентября 1945 года не менее шести месяцев (военврачи, медицинские работники, курсанты);
-
лица, награждѐнные знаком «Жителю блокадного Ленинграда»;
-
лица, работавшие в период Великой Отечественной войны на военных объектах, а также члены экипажей судов транспортного флота, интернированных в начале Великой Отечественной войны в портах других государств;
-
члены семей погибших (умерших) инвалидов войны, участников Великой Отечественной войны и ветеранов боевых действий, а также члены семей погибших
работников госпиталей и больниц города Ленинграда;
-
инвалиды;
-
дети-инвалиды.
-
-
Требования к оформлению рецептов на получение ЛП бесплатно или со скидкой 50% регламентированы приказом Минздрава России от 20 декабря 2012 г. № 1175н «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учѐта и хранения» с изменениями, внесѐнными приказом Минздрава от 30 июня 2015 г. № 386н.
Оформление рецептурных бланков:
-
На рецептурных бланках формы № 148-000/у-04(л) и № 148-000/у-06(л) в левом верхнем углу проставляется штамп медицинской организации с указанием еѐ наименования, адреса и телефона.
Дополнительно на рецептурных бланках формы № 148-000/у-04(л) и № 148-000/у- 06(л) проставляется код медицинской организации.
Серия рецептурного бланка формы № 148-000/у-04(л) и формы № 148-000/у-06(л) включает код субъекта Российской Федерации, соответствующий двум первым цифрам Общероссийского классификатора объектов административно-территориального деления (ОКАТО).
-
На рецептурных бланках, оформляемых индивидуальными предпринимателями, имеющими лицензию на медицинскую деятельность, в верхнем левом углу типографским способом или путѐм проставления штампа должен быть указан адрес врача, номер и дата лицензии, наименование органа государственной власти, выдавшего лицензию.
-
Рецептурные бланки формы № 148-000/у-04(л) заполняются врачом разборчиво, чѐтко, чернилами или шариковой ручкой.
-
Допускается оформление всех реквизитов рецептурных бланков формы
№148-000/у-06(л) с использованием компьютерных технологий, за исключением графы
«Rp» (наименование лекарственного препарата, его дозировка, количество, способ и продолжительность применения).
-
Оформление рецептурных бланков формы № 148-000/у-04(л) и формы № 148- 000/у-06 (л) включает в себя цифровое кодирование.
Цифровое кодирование указанных рецептурных бланков включает в себя:
-
код медицинской организации в соответствии с Основным государственным регистрационным номером (ОГРН), проставляемый при изготовлении рецептурных бланков;
-
код категории граждан (SSS), имеющих право на получение лекарственных препаратов в соответствии со статьѐй 6.1 Федерального закона от 17 июля 1999 г. № 178- ФЗ «О государственной социальной помощи» [1], и код нозологической формы (LLLLL) по МКБ-10, заполняемые лечащим врачом путѐм занесения каждой цифры в пустые ячейки, при этом точка проставляется в отдельной ячейке;
-
отметка об источнике финансирования (федеральный бюджет [1], бюджет субъекта Российской Федерации [2], муниципальный бюджет [3]) и проценте оплаты
рецепта (бесплатно [1], 50% [2]), осуществляемая медицинским работником;
-
код медицинского работника указывается медицинским работником в соответствии с установленным органом исполнительной власти субъекта Российской Федерации в области охраны здоровья граждан перечнем кодов медицинских работников, имеющих право на выписку лекарственных препаратов;
-
код лекарственного препарата, проставляемый в аптечной организации при отпуске лекарственных препаратов, выписанных на рецептурных бланках формы № 148- 000/у-04(л) и формы № 148-000/у-06(л).
-
-
В рецептурных бланках № 148-000/у-04(л) и формы № 148-000/у-06(л) в графах
«ФИО пациента» указываются полностью фамилия, имя и отчество пациента.
-
В рецептурных бланках формы № 148-000/у-04(л) и формы № 148-000/у-06(л) в графе «Дата рождения» указывается дата рождения пациента (число, месяц, год).
-
В рецептурных бланках формы № 148-000/у-04(л) и формы № 148-000/у-06(л) в графах «СНИЛС» и «№ полиса обязательного медицинского страхования» указываются страховой номер индивидуального лицевого счѐта гражданина в Пенсионном фонде Российской Федерации (СНИЛС) (при наличии) и номер полиса обязательного медицинского страхования.
-
В рецептурных бланках формы № 148-000/у-04(л) и формы № 148-000/у-06(л) в графе «Адрес или № медицинской карты амбулаторного пациента (истории развития ребѐнка)» указывается адрес или номер медицинской карты амбулаторного пациента (истории развития ребѐнка).
-
В графе «ФИО лечащего врача» рецептурных бланков указываются полностью фамилия, имя, отчество медицинского работника, имеющего право назначения и выписывания лекарственных препаратов.
-
В графе «Rp» рецептурных бланков указывается:
-
на латинском языке наименование лекарственного препарата (международное непатентованное или группировочное, либо торговое), его дозировка;
-
на русском или русском и национальном языках способ применения лекарственного препарата.
-
-
Запрещается ограничиваться общими указаниями, например, «Внутреннее»,
«Известно».
Разрешаются только принятые правилами сокращения обозначений; твѐрдые и сыпучие фармацевтические субстанции выписываются в граммах (0,001; 0,5; 1,0), жидкие
-
в миллилитрах, граммах и каплях.
-
-
Рецепт, выписанный на рецептурном бланке, подписывается медицинским работником и заверяется его личной печатью.
Дополнительно рецепт, выписанный на рецептурном бланке формы № 148-000/у- 04(л) и формы № 148-000/у-06(л), заверяется печатью медицинской организации «Для рецептов».
-
На одном рецептурном бланке формы № 148-000/у-04(л) и формы № 148-000/у- 06(л) разрешается выписывать только одно наименование лекарственного препарата.
-
Исправления в рецепте, выписанном на рецептурном бланке, не допускаются.
-
Срок действия рецепта, выписанного на рецептурном бланке формы № 148- 000/у-04(л) и формы № 148-000/у-06(л) (15 дней, 30 дней, 90 дней) указывается путѐм зачѐркивания или подчѐркивания.
-
При выписке лекарственного препарата по решению врачебной комиссии на обороте рецептурного бланка формы № 148-000/у-04(л) и формы № 148-000/у-06(л) ставится специальная отметка (штамп).
-
На рецептурном бланке формы № 148-000/у-04(л) и формы № 148-000/у-06(л) внизу имеется линия отрыва, разделяющая рецептурный бланк и корешок.
Корешок от рецепта, выписанного на указанном рецептурном бланке, выдаѐтся пациенту (лицу, его представляющему) в аптечной организации, на корешке делается отметка о наименовании лекарственного препарата, дозировке, количестве, способе применения, и он остаѐтся у пациента (лица, его представляющего).
Рецепт должен храниться в аптеке 5 лет.
На рецептурном бланке формы № 148-000/у-04(л) и формы № 148-000/у-06(л) рецепт выписывается медицинским работником в двух экземплярах, с одним экземпляром которого пациент обращается в аптечную организацию. Второй экземпляр рецепта приобщается к медицинской карте пациента.
Наркотические и психотропные лекарственные препараты списка II Перечня для лечения граждан, имеющих право на бесплатное получение лекарственных препаратов или получение лекарственных препаратов со скидкой, выписываются на специальном рецептурном бланке на наркотическое средство и психотропное вещество (срок действия 15 дней), к которому дополнительно выписываются рецепты в двух экземплярах на рецептурном бланке формы № 148-000/у-04 (л) или формы № 148-000/у-06 (л).
Психотропные лекарственные препараты списка III Перечня, иные лекарственные средства, подлежащие предметно-количественному учѐту, лекарственные препараты, обладающие анаболической активностью, комбинированные лекарственные препараты, предназначенные для лечения граждан, имеющих право на бесплатное получение лекарственных препаратов или получение лекарственных препаратов со скидкой, выписываются на рецептурном бланке № 148-000/у-88 (срок действия 15 дней), к которому дополнительно выписываются рецепты в двух экземплярах на рецептурном бланке формы № 148-000/у-04 (л) или формы № 148-000/у-06 (л).
Получение государственной социальной помощи в виде набора социальных услуг включает в себя:
-
обеспечение в соответствии со стандартами медицинской помощи необходимыми лекарственными препаратами для медицинского применения по рецептам на лекарственные препараты;
-
обеспечение медицинскими изделиями по рецептам на медицинские изделия;
-
обеспечение специализированными продуктами лечебного питания для детей- инвалидов.
-
Тиазидоподобный диуретик.
Механизм действия: нарушает реабсорбцию Na+ в начальном сегменте кортикального отдела петли Генле, увеличивает выведение с мочой Na+, Cl- и в меньшей степени K+ и Mg2+.
-
Диуретический, гипотензивный и сосудорасширяющий. Лечение артериальной гипертензии.
-
Аптечная организация обязана вести компьютерный учѐт всех лекарственных препаратов, отпущенных по бесплатным рецептам по единой программе учѐта бесплатных лекарств.
Аптечная организация обеспечивает автоматизированный персонифицированный учѐт отпущенных лекарственных средств гражданам в соответствии с договором. Для этого должностные лица ежедневно вводят необходимую информацию в базу данных компьютера на основании бесплатных рецептов, по которым отпущены лекарственные препараты.
Ежемесячно аптечная организация предоставляет фармацевтической организации отчѐты в электронном и бумажном варианте согласно перечню и порядку, определѐнному договором, а также документы на оплату отпущенных лекарственных препаратов.
В соответствии с приказом ФФОМС от 20.10.2005 г. № 103 «О распоряжении Правительства Российской Федерации» (сейчас этот приказ отменѐн, но формами продолжают пользоваться), аптечная организация обязана представлять в ТФОМС через фармацевтическую организацию, обеспечивающую доставку и бесплатный отпуск необходимых лекарственных препаратов, в срок до 10 числа каждого месяца подписанные в трѐх экземплярах документы за прошедший месяц, подтверждающие отпуск лекарственных препаратов льготным категориям граждан:
-
счѐт на возмещение суммы за отпущенные лекарственные препараты отдельным категориям граждан;
-
счѐт-фактуру на возмещение суммы за отпущенные лекарственные препараты отдельным категориям граждан;
-
реестр рецептов лекарственных препаратов, отпущенных при оказании дополнительной бесплатной медицинской помощи (РР-1);
-
реестр ЛП, отпущенных по рецептам врача (фельдшера) при оказании дополнительной бесплатной медицинской помощи отдельным категориям граждан (РЛ-1).
СИТУАЦИОННАЯ ЗАДАЧА K002589
-
Мазь комбинированного типа: ментол – мазь-раствор, эфедрина гидрохлорид – мазь-эмульсия.
-
Ментол растворяют в вазелине при температуре не выше 40-45 °С. Эфедрина гидрохлорид растворяют в воде, взятой с учѐтом еѐ содержания в ланолине водном и эмульгируют ланолином безводным.
3.

4.
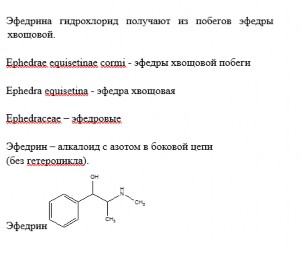
5. Основа относится к дифильным водосодержащим (эмульсионным) основам: вазелин – гидрофобный компонент, ланолин – водосодержащий дифильный компонент.
СИТУАЦИОННАЯ ЗАДАЧА K002590
-
Раздражающее и отвлекающее средство.
Рефлекторно возбуждает дыхательный центр, повышает ЧСС.
-
Антисептическое средство из группы окислителей. Обладает также гемостатическим эффектом. При контакте перекиси водорода с повреждѐнной кожей и слизистыми оболочками высвобождается активный кислород, который вызывает денатурацию белков, при этом происходит механическое очищение раны и инактивация органических веществ (протеины, кровь, гной).
-
Антисептик из группы красителей, механизм действия связан с денатурацией белков микроорганизмов. Эффективен в отношении золотистого стафилококка, некоторых видов грибков, других возбудителей. Применяют для лечения инфекций кожи.
-
Учѐт расхода товаров на оказание первой медицинской помощи регистрируется в журнале учѐта медицинских товаров, израсходованных на оказание первой медицинской помощи, в котором фиксируются все случаи расхода товаров на оказание ПМП.
Журнал должен быть пронумерован, прошнурован и заверен печатью и подписью руководителя организации. Записи в журнале ПМП должны производиться сразу же после оказания первой медицинской помощи в аптеке.
В журнал заносятся следующие сведения: номер по порядку, дата оказания помощи, фамилия пострадавшего, его адрес, характер несчастного случая, наименование и количество израсходованных медикаментов и перевязочных материалов, стоимость этих товаров по оптовым и розничным ценам, подписи оказавшего помощь и пострадавшего. Помощь оказывается бесплатно.
Использование товара на оказание ПМП – это документированный расход товара (прочий документированный расход).
По окончании месяца на основании этого журнала составляют справку об использовании товаров на оказание ПМП в 2 экземплярах:
1 – у материально-ответственного лица, а 2 – прилагается к товарному отчѐту.
Данные со справки заносятся в расходную часть товарного отчѐта аптеки (прочий документированный расход), и оптовая стоимость израсходованных товаров относится на издержки обращения аптеки.
-
Раствор аммиака, 3% раствор перекиси водорода, спиртовой раствор бриллиантового зелѐного – хранение регламентировано приказом Минздрава от 23 августа 2010 года № 706н «Об утверждении Правил хранения лекарственных средств».
Согласно требованиям этого приказа, хранение лекарственных препаратов для медицинского применения осуществляется в соответствии с требованиями государственной фармакопеи и нормативной документации, а также с учѐтом свойств веществ, входящих в их состав.
Хранение лекарственных препаратов для медицинского применения осуществляется в соответствии с требованиями к их хранению, указанными на вторичной (потребительской) упаковке указанного лекарственного препарата.
Спиртовой раствор бриллиантового зелѐного – обладает легковоспламеняющимися свойствами, хранится отдельно от других ЛП, в плотно укупоренной прочной стеклянной таре.
Бинты стерильные – хранение регламентировано приказом Минздрава РФ от 13 ноября 1996 года № 377 «Об утверждении Инструкции по организации хранения в аптечных учреждениях различных групп лекарственных средств и изделий медицинского назначения».
Стерильные бинты хранятся в заводской упаковке в сухом проветриваемом помещении в шкафах, ящиках, на стеллажах и поддонах, которые должны быть выкрашены изнутри светлой масляной краской и содержаться в чистоте.
СИТУАЦИОННАЯ ЗАДАЧА K002616
-
Провизор поступил правильно. Лекарственный препарат Коделак относится к лекарственным препаратам для медицинского применения, содержащих кроме малых количеств наркотических средств, психотропных веществ и их прекурсоров другие фармакологические активные вещества (содержит кодеин - наркотическое средство
списка II Перечня НС, ПВ и их прекурсоров, утверждѐнного постановлением Правительства РФ № 681 от 1998 г.). В соответствии с приказами МЗ РФ от 20.12.2012 г.
№ 1175н, от 17.05.2012 г. № 562н отпуск осуществляется по рецептам, выписанным на рецептурных бланках формы № 148-000/у-88 который должен иметь номер и серию.
На рецептурном бланке ставится штамп медицинской организации с указанием адреса и телефона, дата выписки, ФИО пациента и медицинского работника указывается полностью, в графе возраст указывается количество полных лет, в графе «Адрес или номер медицинской карты пациента, получающего медицинскую помощь в амбулаторных условиях» указывается полный почтовый адрес места жительства (места пребывания или места фактического проживания) пациента или номер медицинской карты пациента, получающего медицинскую помощь в амбулаторных условиях.
В графе «Rp» указывается: на латинском языке наименование ЛП (международное непатентованное или группировочное, либо торговое), его дозировка, количество;
на русском или русском и национальном языках способ применения лекарственного препарата. Рецепт, подписывается медицинским работником и заверяется его личной печатью. Дополнительно заверяется печатью медицинской организации «Для рецептов».
Срок действия рецепта составляет 15 дней, срок хранения – 3 года.
-
При отпуске из аптеки нормируется количество кодеина. Приказом МЗ РФ
№ 1175н установлено предельно допустимое количество кодеина на 1 рецепт – 0,2 г. Так как в составе препарата в 1 таблетке содержится кодеина – 8 мг, общее количество кодеина с учѐтом 10 таблеток в одной упаковке составляет 80 мг или 0,08 г. (0,008 г×10=0,08 г).
Следовательно, из аптеки может быть отпущено 2 упаковки препарата Коделак
№10, так как не будет превышена установленная норма отпуска кодеина в 0,2 г по одному рецепту (0,08 г×2 уп. №10 = 0,16 г < 0,2 г).
Данный препарат подлежит предметно-количественному учѐту в аптечных организациях согласно приказу МЗ РФ от 22.04.2014 г. № 183н.
При приѐмке препарата Коделак сведения о поступлении препарата вносятся в Журнал регистрации операций, связанных с оборотом остальных лекарственных средств, подлежащих предметно-количественному учѐту.
-
Биологически активные вещества, которые содержатся в траве термопсиса, оказывают выраженное возбуждающее действие на рвотный и дыхательный центр. Содержащиеся в термопсисе изохилиновые алкалоиды, повышают активность мерцательного эпителия и усиливают функции бронхиальных желѐз, что значительно усиливает отхаркивающее действие лекарственного средства и облегчает выведение секрета.
Кодеин, относится к группе наркотических анальгетиков, снижает возбудимость кашлевого центра, при этом, не угнетая дыхательный центр, а также значительно уменьшает выраженность непродуктивного кашля, независимо от его этиологии.
Гидрокарбонат натрия, проникая в слизистую бронхов, изменяет еѐ кислотный баланс в щелочную сторону, что способствует быстрому снижению вязкости мокроты. Также обладает стимулирующим действием на моторику реснитчатого эпителия. Ярко
выраженным отхаркивающим действием обладает корень солодки, который эффективно стимулирует работу реснитчатого эпителия и значительно повышает секреторную активность бронхиальных желѐз. Также корень солодки оказывает слабо выраженное спазмолитическое воздействие на гладкую мускулатуру бронхов.
-
Бутамират (Синекод) – противокашлевой препарат центрального действия, не относится к алкалоидам опия ни химически, ни фармакологически. Подавляет кашель, обладая прямым влиянием на кашлевой центр.
Оказывает бронходилатирующее действие. Способствует облегчению дыхания, улучшая показатели спирометрии и оксигенации крови.
Будамират (Коделак Нео) – противокашлевое неопиоидное средство, обладает прямым влиянием на кашлевой центр. Оказывает противокашлевое, отхаркивающее, умеренное бронходилатирующее и противовоспалительное действие, улучшает показатели спирометрии (снижает сопротивление дыхательных путей) и оксигенацию крови.
-
Рыночный спрос на товар – это количество товара, которое может быть приобретено определѐнной группой потребителей в указанном районе, в заданный отрезок времени, в одной и той же рыночной среде.
Для препаратов, отпускаемых без рецепта, исследуются либо объѐм продаж – характеризующий затраты, которые совершили потребители при приобретении этих препаратов за определѐнный период времени, либо частота покупок и объѐмы продаж в натуральных показателях (упаковках) совместно со средней розничной ценой препарата. Рекомендуется учитывать также размер дефектуры, который свидетельствует о наличии неудовлетворѐнного спроса.
СИТУАЦИОННАЯ ЗАДАЧА K002617
-
Данное водное извлечение требует разных режимов экстракции. Из листьев сенны готовят настой с полным охлаждением, из корней крушины – отвар без охлаждения.
-
В соответствии с приказом № 751н от 26.10.2015 г. срок годности настоев и отваров не более 2 суток.
-
Cassia acutifolia – кассия остролистная, антраценпроизводные – сеннозиды А и В.
Frangula alnus – крушина ольховидная, антраценпроизводные – франгуларозид, франгулин, франгулаэмодин.
Оказывают слабительное действие.
-
В соответствии с требованиями ОФС ГФ 13 хранение настоев и отваров осуществляется при температуре от 2 до 8 °С, в защищѐнном от света месте.
-
В соответствии с приказом № 751н от 26.10.2015 г. при изготовлении водных извлечений из ЛРС не допускается использование концентрированных растворов лекарственных средств.
СИТУАЦИОННАЯ ЗАДАЧА K002618
-
Рассчитаем объѐм продаж при первом варианте реализации: 120×124,74=14968, 80 руб.
Рассчитаем уровень торговой наценки: (124,74-90,00):90×100%=38,6% Рассчитаем цену во втором варианте:
(90×0,9)×1,386=112,27 руб.
Рассчитываем объѐм продаж: 130×112,27=14595,10 руб.
Таким образом, разница составила: 14595,10-14968,8=-373,7 руб.
То есть, объѐм продаж, несмотря на снижение цены, уменьшился на 373,7. То есть, цель не была достигнута.
Повышение объѐма продаж возможно в случае реализации более 134 упаковок. (14968,8:112,27=133 уп.).
-
Формирование цены на лекарственный препарат будет зависеть от того какой ценовой стратегии придерживается аптека. Если, например, это политика «средних цен», то цены определяются рынком, и для формирования цены необходимо знать цены ближайших по локализации двух-трѐх конкурентов, оценить предложения поставщиков, рассчитать средний уровень дохода аптеки при формировании цены на 3–5% ниже средней цены конкурентов. Если при расчѐтах будет получен уровень дохода, превышающий уровень расходов, то цена будет приемлемой. Затем проводят мониторинг результатов фактических продаж (объѐмы продаж, доход от реализации) и анализируют результаты.
-
Блокатор медленных кальциевых каналов преимущественно сосудов головного мозга, производное дифенилпиперазина, сосудорасширяющее действие.
-
Показан для лечения симптомов цереброваскулярного происхождения, вестибулярные нарушения, мигрень, нарушения периферического кровообращения.
-
Для поиска поставщиков используется стандартная схема, состоящая из трѐх этапов:
-
этап.
Поиск потенциальных поставщиков. Поиск включает следующие действия:
-
-
проведение конкурсов (тендеров);
-
изучение рекламных материалов (фирменных каталогов, объявлений в средствах массовой информации и т.п.);
-
посещение ярмарок, выставок; личные контакты с возможными поставщиками (переписка, телефонные разговоры, деловые встречи).
-
этап.
Анализ надѐжности поставщиков.
Возможными критериями оценки поставщика являются:
-
-
цена и качество продукции;
-
выполнение обязательств по срокам поставок, ассортименту, комплектности, количеству поставляемой продукции;
-
финансовое положение поставщика;
-
сроки выполнения текущих и экстренных заказов и др. 3 этап.
Размещение заказа и его реализация.
Выбранный товар для предприятия может закупаться как непосредственно у производителя, так и у посредников, дилеров. Основным фактором, влияющим на выбор поставщика, является номенклатура товара и его цена. Всѐ зависит от того, на каких условиях осуществляется реализация.
////////////////////////////