содержание .. 20 21 22 23 24 25 26 27 28 29 30 ..
Понятия о химии в парикмахерском деле - часть 2
г) Кислоты и щелочи
Кислоты
Простейшие неорганические кислоты образуются при растворе "не металлоокиси" (это реакция кислорода с неметаллом) в воде. Так образуется серная кислота, сернистая кислота, фосфорная кислота и др.
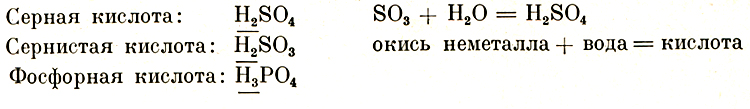
Характерной чертой кислоты является то, что её молекула содержит в себе один или несколько атомов водорода.
Эта "окись водорода" характерна и для других кислот, как, например, винная кислота, лимонная кислота, виноградная кислота. Окись водорода, как мы узнаем позже, может быть заменена металлами.
Таким образом, мы пришли к общему определению понятия кислота.
Кислоты - это соединения водорода, водород которых может быть заменен металлом.
Кислоты, как, например, уксусная кислота, обладают особенным качеством, а именно: они имеют кислый запах.
Но мы не всегда можем положиться на наши органы чувств. Поэтому химия даёт нам возможность при помощи известных вспомогательных средств точно установить, кисло данное вещество или нет. Эти вещества называются "индикаторами" т. е. указателями. Главные из них:
лакмус, метилоранж, фенолфталеин.
Все эти три соединения являются органическими красителями, которые под влиянием кислоты характерно изменяют свой цвет следующим образом:
синий лакмус становится красным, бесцветный фенолфталеин не изменяется, метилоранж становится красным.
Кислая реакция определяется, таким образом, при помощи индикаторов.
Щелочи
Большинство щелочей (называемых также основаниями) возникает из раствора окисей металлов (кислородное соединение одного из металлов) в воде, например:
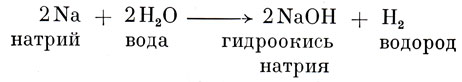
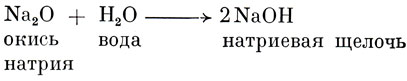
Все щелочи характерны тем, что их молекулы содержат в себе группу гидроксилов (группа ОН).
Щелочи - это соединения, содержащие в своих молекулах группу гидроксилов.
Так, например, нашатырный спирт - это тоже щелочь, возникшая из раствора аммиака (NH3) в воде:
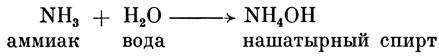
Мы уже говорили, что кислоты можно определить по их кислому запаху или вкусу. Определить же щелочь не так легко. Отличительным признаком щелочей является их ощущаемая скользкость, или мыльность. Для точного определения щелочей пользуются теми же индикаторами, что и при кислотах. Мы можем применять те же индикаторы, так как щелочи дают им другую окраску, нежели кислоты. Так, например, красная лакмусовая бумага под влиянием щелочи становится синей, бесцветный фенолфталеин - красным, а метилоранж - желтым.
Таким образом, с помощью индикаторов можно определить щелочную, то есть основную, реакцию.
Как окрашиваются индикаторы под влиянием кислот и щелочех, видно из таблицы ниже:

д) Нейтрализация
Как мы уже говорили, характерным качеством кислоты является кислотная реакция, а щелочи - щелочная, то есть основная реакция. Если мы какой-нибудь элемент кислоты соединим с основным (щелочным), то оба элемента потеряют свои основные качества. Кислота и щелочь исчезнут, и полученное новое вещество будет реагировать нейтрально.
Это нейтральное вещество, полученное из кислоты и щелочи, называется соль. Взаимодействие кислоты с основанием, в результате которого получаются соль и вода, называется нейтрализацией.
Таким образом: соль является продуктом нейтрализации кислоты с основанием.
Химической формулой этот процесс будет выражен следующим образом:
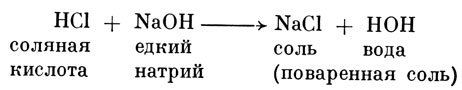
Химической характерной чертой кислоты является водород (Н), а щелочи - группа гидроксилов (ОН). При нейтрализации (т. е. при образовании соли) обе эти группы, вызывающие щелочную реакцию, всегда образуют воду.
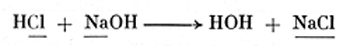
При этом теряется как характер кислоты, так и основы. Остаток (кислоты и основы) образует тогда соль. Дальнейшее образование соли вызывается окисью металла + кислота или металл + кислота. Об этом мы дальше говорить не будем, так как оно нас не интересует.
содержание .. 20 21 22 23 24 25 26 27 28 29 30 ..