содержание .. 20 21 22 23 24 25 26 27 28 29 30 ..
III.
Понятия о химии в парикмахерском деле - часть 1
1. Основы химии
Химия занимает очень важное место в парикмахерской профессии. Сегодня
парикмахеру для его работы недостаточно обладать одним профессиональным
мастерством, нет - он должен быть знаком и с происходящими химическими
процессами, с действием и влиянием на кожу и волосы применяемых им
препаратов.
а) Химия и физика
Химия - одна из старейших наук. Уже в глубокой древности был сделан ряд
наблюдений и открытий, относящихся к химии.
Алхимики средневековья искали так называемый философский камень. Их
опыты превращения простых металлов в драгоценные хотя и были безуспешны,
но приводили ко все большим открытиям и изобретениям. Таким образом, из
множества единичных результатов развилась постепенно наука - химия. Она
является одной из областей естествознания. Химия делится на органическую
и неорганическую химию. Органическая химия занимается изучением
соединений углерода, а неорганическая - изучением свойств и соединений
остальных веществ. Задача химии заключается в исследовании строения и
изменения веществ в окружающей нас природе, с последующим использованием
результатов этих исследований на пользу человеку.
Родственна с химией другая отрасль естествознания, а именно физика. Она
изучает только состояние и изменение состояния веществ (элементов).
Итак, запомним:
Химия - это наука, изучающая вещества, их состав, строение, свойства и
взаимные превращения.
Физика - это наука, изучающая состояние и изменение состояния тел. Для
лучшего уяснения этих формулировок приведём два примера. Пример
химического процесса:
Если держать кусок железа продолжительное время на сыром воздухе, то в
конце концов вещество "железо" исчезает и образуется новое вещество
"гидроокись железа" (ржавчина - продолжительное вещественное изменение).
Пример физического процесса:
Если нагревать кусок металлической проволоки, то она раскалится
докрасна, только находясь под влиянием источника тепла. Проволока под
влиянием тепла расширяется, но, охладившись, она приходит снова в
прежнее состояние. Здесь происходит временное изменение состояния
вещества, изменения же самого вещества здесь не происходит. Парикмахеру
приходится постоянно работать с химическими препаратами, как, например,
краска для волос, раствор для шестимесячной завивки, перекись водорода,
нашатырный спирт, мыло и пр. Поэтому очень важно, чтобы он умел делать
различие между действием химических и физических процессов. Если,
например, волосы или кожа подверглись влиянию химического процесса, то
устранить это влияние можно только с трудом, и может случиться, что его
вред приведет к тяжелым последствиям.
б) Что такое вещества?
В химии мы различаем:
- Основные вещества или элементы - это вещества, качества которых не поддаются изменению химических или физических процессов, как, например, углерод, кислород.
- Соединения состоят из нескольких элементов, находящихся в известном весовом соотношении между собой. Так, например, из соединения (реакции) углерода и кислорода получается углекислый газ (двуокись водорода). Эти новые элементы обладают совершенно другими качествами, чем их составные части, и они могут быть снова разъединены химическим путём.
- Смеси - это механические соединения различных веществ. Они состоят из соединений различных веществ, взятых в любом количественном соотношении, которые при этом сохраняют свои основные качества. Они могут быть снова разъединены физическим путём.
Элементы
В настоящее время известны 100 элементов, большая часть которых находится в природе и только немногие из них могут быть созданы искусственным путём.
Делятся они следующим образом:

Для упрощения объяснения химических реакций введены для всех элементов сокращения, называемые "знаками". При этом применяют первоначальные буквы названий элементов на греческом или латинском языке. Так, например, обозначают:

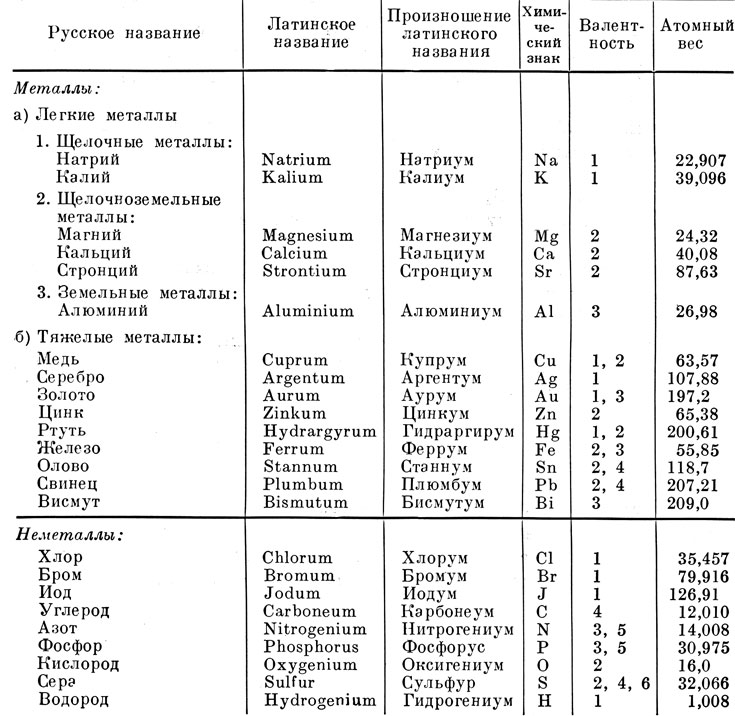
Таблица важнейших элементов
Каждое вещество состоит из множества мелких частиц. Кусок железа, например, состоит из множества мельчайших частиц. Такие мельчайшие химически неделимые частицы вещества называют "атомами" (от греческого "атомос"- неделимый).
Запомним:
Атомы - это мельчайшие частицы химического элемента (но не мельчайшие элементарные частицы вещества (материи) вообще).
Соединения
Если два элемента соединяются, образуя вместе одно более сложное вещество, то такой химический процесс называется соединением (реакцией).
Такое соединение образует новое вещество, имеющее совершенно другие качества, нежели элементы, из которых оно произошло.
Например: железо и кислород образуют гидроокись железа, вещество, не обладающее магнитными свойствами железа и притом не газообразное, как кислород.
Для обозначения химических соединений складывают все знаки входящих в них элементов, например:
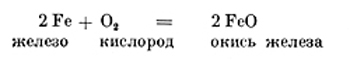
Тут мы получили упрощенную формулу химического соединения. Она показывает нам, какие и сколько химических частиц входят в данное соединение.
Если же отдельные элементы участвуют в соединении не одной только частицей, а несколькими, тогда указывают их количество арабской цифрой у основания химического знака, например:
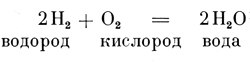
* (Сравни раздел "в" о валентности.)
Соединения также состоят из множества мелких частиц.
Мельчайшая частица химического соединения называется "молекулой". Молекулы не поддаются дальнейшему механическому разложению (дроблению) без изменения качеств вещества. Они состоят из атомов элементов.
Молекулы-это мельчайшие частицы химического соединения.
в) Валентность
Мы знаем, что элементы могут объединяться в соединения в различных количественных соотношениях, как, например:
1 атом железа и 1 атом кислорода - в окись железа,
2 атома водорода и 1 атом кислорода - в воду.
Это явление не случайное, оно основано на том, что каждый элемент имеет свою "валентность".
Валентность - это свойство атомов одного элемента вступать в химическое соединение с атомами другого элемента. Масштабом служит известный одновалентный элемент водород, который никогда не входит в химическое соединение с двумя или большим количеством атомов. Валентность одного элемента определяется количеством атомов водорода, входящих в химическое соединение.
Многие элементы многовалентны, например, железо двух-, трёх- и шестивалентно.
Для получения более наглядной картины сравним атомы с шариками, которые, в зависимости от их валентности, как бы протягивают друг другу руки, чтобы удержаться (см. рис. 83).
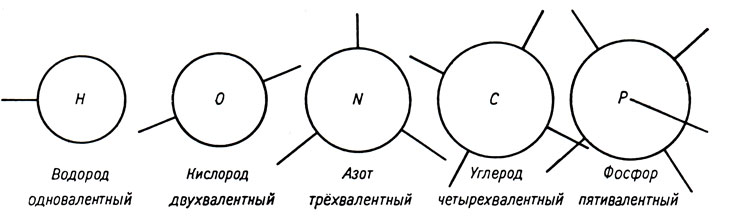
Рис. 83
Отсюда видно, что водород одновалентен, кислород двухвалентен, азот трёхвалентен, углерод четырехвалентен и фосфор пятивалентный элемент. (Сравните с таблицей элементов на стр. 91.)
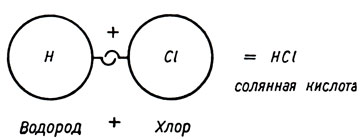
Рис. 84
В соответствии со своей валентностью атом одного элемента может входить в соединение с атомами других элементов. Водород (Н) и хлор (С1) оба являются одновалентными элементами. Поэтому один атом Н и один атом С1, как показано выше, соединяются в одну молекулу (см. рис. 84).?
Трехвалентный же азот (N) соединяется с одновалентным водородом (Н), как видно ниже на рис. 86.
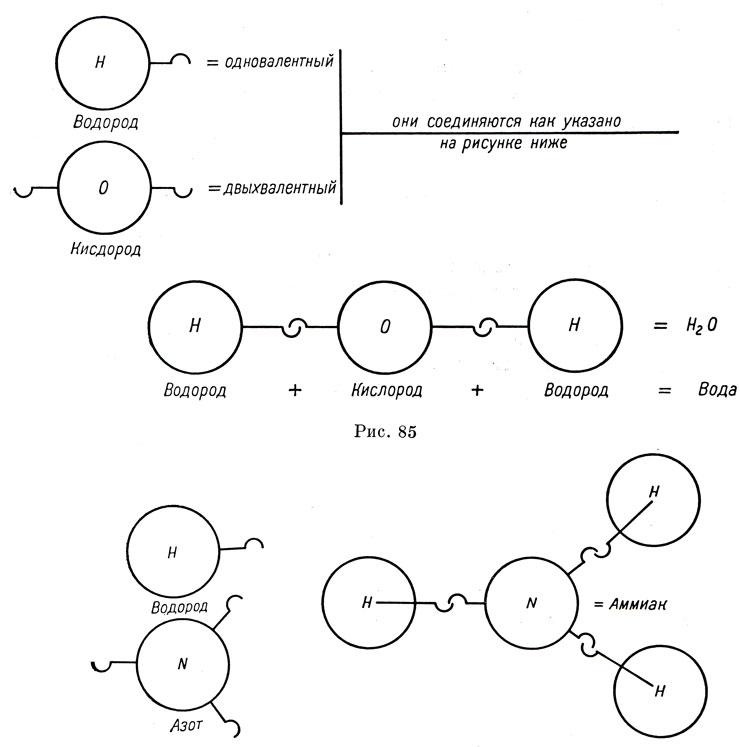
Рис. 86
содержание .. 20 21 22 23 24 25 26 27 28 29 30 ..