содержание .. 14 15 16 17 ..
Типовые патологические процессы. Экзаменационные вопросы с ответами (2020 год)
27) Условия, необходимые для развития хронического воспалния.
Формированию хронического воспаления, которое, как правило, носит пролиферативный характер, способствует наличие раздражите- ля в очаге воспаления, образование эндогенных антигенов и наличие эндогенных факторов, которые изменяют тип клеток и их функцию в очаге воспаления.
Важной причиной формирования хронического воспаления явля- ется образование эндогенных антигенов при аутоиммунных процессах (системной красной волчанке, гломерулонефрите, тиреоидите Хашимито, склеродермии и др.). Среди эндогенных факторов (лимфокинов), обеспечивающих хронизацию воспаления называют митогенетические факторы, кото- рые образуются в очаге воспаления и стимулируют деление мононуклеарных клеток
28) Общие реакции при воспалении. В зависимости от интенсивности и локализации воспаления оно может сопровождаться общими реакциями в виде нарушений нервной и эндокринной систем, в том числе симпато-адреналовой и гипоталамо-гипофизарно-надпочечниковой системы, развитием лихорадки, лейкоцитоза, изменением обмена веществ в организме. В конечном итоге возможно нарушение функций различных органов и систем организма.
29) Биологическое значение воспаления.
С общебиологической точки зрения воспалительная реакция выработана в ходе эволюции и поэтому является защитно-приспособительной. Фиксация в очаге воспаления биологических возбудителей происходит вследствие расстройств крово- и лимфообращения, в результате фагоцитоза, иммунологических реакций, а также бактерицидного действия экссудата и ферментов на микроорганизмы, которые погибают и резорбируются. Кроме этого, необходимо учесть резко повышенную проницаемость сосудов, в результате чего микроорганизмы и чужеродные вещества могут интенсивно выделяться в очаг воспаления и подвергаться там уничтожению и резорбции. Наконец, защитное значение очага воспаления проявляется и в том, что за счет происходящих в очаге воспаления пролиферации и регенерации осуществляется восстановление функционального элемента, хотя бы даже за счет рубца.
30)Общие принципы патогенетической терапии воспаления и их обоснование.
Воспаление представляет собой цепь причинно-следственных отношений, где предыдущее звено влияет на последующее и в конечном итоге на пролиферацию, следствием которой является формирование рубцовых (фиброзных) изменений. Отсюда используемые для лечения противовоспалительные средства могут оказывать влияние на одно или несколько звеньев патогенеза воспаления, ингибируя воспаление в целом.
В зависимости от характера воспаления используются специфическая и неспецифическая терапия. Первая направлена на уничтожение биологического возбудителя (антибиотики, лечебные сыворотки, противотуберкулезные средства и др.), которые обладают как бактерицидным действием, так и, являясь составной частью обмена веществ микроорганизма, нарушают его жизнедеятельность, облегчая разрушение и фагоцитоз. Поэтому уничтожение микроорганизмов или предотвращение действия аллергена являются одной из важных задач в профилактике и лечении инфекционного и аллергического воспаления.
К неспецифическим воздействиям относится влияние измененной температуры, раздражающих веществ на воспаление. Тепло (сухое и влажное, горячий парафин, ультразвук), а также раздражающие средства - горчичники, банки, смазывание скипидаром, йодом) улучшают крово- и лимфообращение, увеличивают гиперемию, экссудацию, эмиграцию лейкоцитов, фагоцитоз, что обеспечивает и ускорение воспаления. Холод, наоборот, тормозит вышеназванные звенья патогенеза воспаления и, таким образом, угнетает его интенсивность.
Противовоспалительное действие антигистаминных препаратов обусловлено торможением мобилизации или блокадой рецепторов гистамина обменных сосудов, вследствие чего тормозится расширение сосудов и проницаемость, особенно венул.
Аспирин, амидопирин, фенилбутазон стабилизируют мембраны лизосом и тормозят образование медиаторов - кининов, простагландинов, серотонина, фактора проницаемости. Более сильным антивоспалительным действием обладают индометацин и бруфен, которые действуют в 10-30 раз эффективнее фенилбутазона и аспирина. Ряд противовоспалительных веществ типа флавоноидов (рутин, венорутон и др.) снижают проницаемость сосудов, улучшают реологию крови и венозное кровообращение.
Для лечения воспаления, особенно аллергического, широко используются глюкокортикоиды, ибо они обеспечивают стабилизацию мембран лизосом, снижение проницаемости, экссудации и эмиграции лейкоцитов, фагоцитоза, угнетают иммунитет и пролиферацию клеток в очаге воспаления, что в целом тормозит воспаление и, в то же время, является причиной вялого заживления ран.
31) Определение понятия «Лихорадка». Этиология лихорадки.
Лихорадка - это типовой, выработанный в ходе эволюции патологический процесс (патологическая реакция), возникающий при действии на организм пирогенов и характеризующийся повышением температуры тела вследствие активной перестройки теплообмена на новый более высокий уровень.
Вещества, вызывающие лихорадку, называются пирогенами.
Экзогенные пирогенны: - липополисахариды,-вирусы и продукты их метаболизма,- грибки, гельминты, простейшие,-белковые компаненты экзотоксинов, возбудителей инфекции.Эндогенные пирогенны:- интерлейкины 1,6. –фактор некроза опухолей,- гамма-интерферон,- простагландины Е2.
Механизм действия пирогенов:1.экзогенные пирогены( первичные пирогены). 2.синтез специальных белковых веществ( вторичных пирогенов).3.гипоталамус 4. Лихорадка.
39) Изменения обмена веществ и физиологических функций при лихорадке.
Обмен веществ: Белковый обмен(развитие отрицательного азотного баланса, распад белка).
Моча(увеличение количества мочевой кислоты, аммиака, креатина).
Углеводный обмен(распад гликогена, увеличение количества глюкозы, пировиноградной кислоты)
Жировой обмен(жирные кислоты интенсивно окисляются, нарастание ацетоновых тел).
Физиологических функций: ССС: учащение сердечного ритма, повышение температуры тела на 1 градус сопровождается учащением ритма сердца на 8-10 ударов.
Кровяное давление повышается на 1 и 2 стадии т.к. происходит возбуждение вазомоторных центров. И снижается в 3 стадию т.к. сосуды расширяются.
Дыхание: 1 стадия частота дыхания уменьшается 2, 3 стадия частота увеличивается.
Почки 1и 2 стадия количество мочи заметно падает, 3 стадия количество мочи заметно возрастает.
40) Биологическое значение лихорадочной реакции.
Положительные:-улучшение кровообращения во внутренних органах; -благотворное течение всех заболеваний; -увеличение обмена веществ.
Отрицательное:
-повреждающее действие высокой температуры на клеточном органном и
организменном уровне.
42) Нарушение энергетического
обмена. Причины, механизмы развития, последствия.
Причины:1. Действие дифтерийного,столбнячного, стафилококкового токсинов; увеличение образования прогестерона, тироксина, адреналина, введение в эксперименте 2,4-динитрофенола, амитала, антимицина. 2. Лихорадка, начальные этапы перегревания, гипотермии. 3. Гипоксия, отравление цианидами; дефицит тироксина,половых гормонов (гипотиреоз, кастрация).
Механизмы:1-2 Активация глигогенолиза, липолиза, глюконеогенеза и, как результат, увеличение глюкозы и жирных кислот —основных энергетических субстратов.
1. Набухание митохондрий, разобщение дыхания и окислительного фосфорилирования, увеличение первичной теплоты и снижение образования макроэргов. 2. Увеличение окислительно-восстановительных процессов и теплообразования. 3. Снижение окислительно-восстановительных процессов и теплообразования.
43. Нарушение расщепления и всасывания углеводов. Причины, механизмы развития, последствия.
|
Схема 4. Нарушения расщепления и всасывания углеводов |
||
|
Причины |
Гидролиз |
Всасывание |
|
Воспаление, опухоли слизистой рта, поджелудочной железы, кишечника; лихорадка, перегревание, обезвоживание, резекция кишечника; наследственные энзимопатии; усиление перистальтики кишечника |
Нарушения нервной и гуморальной регуляции желудочно-кишечного тракта (усиление перистальтики, стресс, дефицит инсулина, глкжокортикоидов, тироксина); отравления флоридзином, монойодацетатом |
|
|
Механизмы |
Дефицит гидролитических ферментов (амилазы, мальтазы, лактазы) |
Нарушения расщепления и фосфорилирования углеводов |
|
Изменения в организме |
Последствия - углеводное голодание -> гипогликемия -> снижение синтеза гликогена в печени и мышцах, исхудание вследствие мобилизации жира из жировых депо. При нарушении расщепления - усиление брожения в толстом кишечнике. Компенсация - активация гликогенолиза, липолиза и глюконеогенеза. |
|
Нарушения межуточного обмена углеводов проявляются в виде изменений гликогенеза, гликолиза, гликогенолиза, глкжонеогенеза
|
Причины |
Расстройства кровообращения, гипоксии, токсикоинфекционные поражения печени, изменения уровня гормонов (инсулина, глюкагона, катехоламинов, соматотропина, глюкокортикоидов, тироксина), дефицит витамина B1, наследственные энзимопатии, тяжелая мышечная работа |
|
Механизмы |
Активация гликолиза, нарушения гликогенеза, гликогенолиза, глюконеогенеза. Торможение окисления в печени и других органах, дефицит ферментов углеводного обмена |
|
Последствия |
Ацидоз, дефицит АТФ, нарушение синтеза рибоз. Возможны парезы, параличи. Нарушения функций органов и систем организма |
44.Нарушение межуточного обмена углеводов. Причины, механизмы развития, последствия.
|
Схема 7. Нарушение межуточного обмена углеводов |
||
|
Причины |
Расстройства кровообращения, гипоксии, токсикоинфекционные поражения печени, изменения уровня гормонов (инсулина, глюкагона, катехоламинов, соматотропина, глюкокортикоидов, тироксина), дефицит витамина B1, наследственные энзимопатии, тяжелая мышечная работа |
|
|
Механизмы |
Активация гликолиза, нарушения гликогенеза, гликогенолиза, глюконеогенеза. Торможение окисления в печени и других органах, дефицит ферментов углеводного обмена |
|
|
Последствия |
Ацидоз, дефицит АТФ, нарушение синтеза рибоз. Возможны парезы, параличи. Нарушения функций органов и систем организма |
|
45.Этиология и патогенез гипергликемии.
Этиология Сахарный диабет Хроническая гипергликемия, которая персистирует независимо от состояния больного, чаще всего бывает в случае сахарного диабета и фактически является основной характеристикой этого заболевания Эта форма гипергликемии вызвана недостаточным уровнем инсулина. Инсулин катализирует транспорт глюкозы через клеточные мембраны, благодаря чему уровень свободного сахара в крови понижается. Расстройства питания Нарушения в питании могут привести к острой недиабетической гипергликемии, например, при нервной булимии, когда человек не контролирует количество съеденной пищи и соответственно получает огромную калорийность за один приём пищи. Таким образом из пищи поступает большое количество простых и сложных углеводов. Некоторые лекарственные вещества способны увеличивать риск развития гипергликемии: β-блокаторы, тиазидные диуретики, кортикостероиды, ниацин, фентамидин, ингибиторы протеаз, L-аспарагиназа и некоторые антидепрессанты. Биотин-авитаминоз также увеличивает риск развития гипергликемии.
Стресс У большинства пациентов, перенёсших острый стресс (инсульт или инфаркт миокарда), гипергликемия способна развиться даже вне рамок диагноза «сахарный диабет». Наблюдения за пациентами и исследования на животных показали, что подобная постстрессовая гипергликемия ассоциирована с более высокой летальностью при инсульте и инфаркте.
Гипергликемия может развиваться на фоне инфекции и воспалительного процесса или стресса. Запускают этот процесс эндогенные контринсулиновые гормоны (катехоламины, глюкокортикоиды и другие). Поэтому повышение уровня глюкозы в крови не должно сразу расцениваться как сахарный диабет 2-го типа — для начала следует исключить все другие причины (в том числе и сахарный диабет у детей, который часто манифестирует именно в подобных ситуациях).
Патогенез
Гипергликемия - связана с избыточным образованием глюкагона- на, под влиянием которого тормозится активность гексокиназы (и, следовательно, нарушается образование из глюкозы глюкозо-6-фосфата), активируется глюкозо-6-фосфатаза (под влиянием этого фермента глюкозо-6-фосфат распадается до глюкозы), в два раза усиливается глюконеогенез в печени, почках, эпителии кишечника. Источником новообразования глюкозы являются пируват, лактат, глицерин, аминокислоты, жирные кислоты с нечетным количеством углеродных атомов
46.Этиология и патогенез гипогликемии.
Гипогликемия – клинический синдром, обусловленный патологически низким уровнем глюкозы в плазме крови
Основной причиной развития гипогликемии является избыток инсулина в организме по отношению к количеству углеводов, поступающих с пищей или из эндогенных источников (продукция глюкозы печенью), а также ускоренная утилизация углеводов при интенсивной мышечной работе
Этиология
Следующие факторы: чрезмерная физическая нагрузка, употребление алкоголя, нарушение диеты в виде неправильного режима приема пищи или недостаточного содержания в ней углеводов, а также передозировка инсулина или таблетированных сахароснижающих препаратов. Развитию гипогликемии способствует первый триместр беременности, роды, хронический гепатит и гепатоз при сахарном диабете, нефропатия с почечной недостаточностью, недостаточность коры надпочечников и щитовидной железы, а также прием некоторых лекарственных препаратов, например салицилатов.
Патогенез
Механизм развития гипогликемии может значительно отличаться в зависимости от этиологии. Так, например, при употреблении этанола, наблюдается следующая картина.
Метаболизм этанола в печени катализируется алкогольдегидрогеназой. Кофактором этого фермента служит НАД — вещество, необходимое для глюконеогенеза. Приём этанола приводит к быстрому расходованию НАД и резкому торможению глюконеогенеза в печени. Поэтому алкогольная гипогликемия возникает при истощении запасов гликогена, когда для поддержания нормогликемии особенно необходим глюконеогенез. Такая ситуация наиболее вероятна при недостаточном питании. Чаще всего алкогольная гипогликемия наблюдается у истощённых больных алкоголизмом, но бывает и у здоровых людей после эпизодических приёмов большого количества алкоголя или даже небольшой дозы алкоголя, но натощак. Необходимо подчеркнуть, что алкоголь снижает концентрацию глюкозы в плазме больных с нормальной функцией печени. Особенно чувствительны к алкоголю дети
47. Нарушение расщепления и всасывания белков. Причины, механизмы развития, последствия.
|
|
Нарушения гидролиза |
Нарушения всасывания |
|
ПРИЧИНЫ |
Воспаление, опухоли, резекции желудка и кишечника, усиле- ние перистальтики (нервные влияния, снижение кислотности желудка, прием недоброкачественной пищи) |
|
|
МЕХАНИЗМЫ |
Дефицит эндопептидаз (пепсин, трипсин, химот- рипсин) и экзопептидаз (карбо-, амино- и дипеп- тидазы) |
Дефицит АТФ (всасывание амино- кислот - активный процесс и проис- ходит с участием АТФ) |
|
ПОСЛЕДСТВИЯ ДЛЯ ОГРАНИЗМА |
Белковое голодание → гипоптротеинемия → отеки, анемия, нарушения иммунитета → склонность к инфекционным процессам; диарея, нарушение транспорта гормонов. Активация катаболизма белков → атрофия мышц, лимфоид- ных узлов, желудочно-кишечного тракта с последующим усугублением нарушений процессов гидролиза и всасывания не только белков, витаминов, но и других веществ; отрицательный азотистый баланс. Всасывание нерасщепленного белка → аллергизация орга- низма. При поступлении нерасщепленных белков в толстый кишечник усиливаются процессы бактериального расщепления (гниения) с образованием аминов (гистамин, тирамин, кадаверин, путресцин) и ароматических токсических соединений (ин- дол, фенол, крезол, скатол). |
|
48. Расстройства межуточного обмена белков. Нарушение синтеза и катаболизма белков, нарушение превращения аминокислот.
Нарушения межуточного обмена белков включают недостаточность синтеза, усиление синтеза и распада белков, нарушения превращения аминокислот в организме.
Биосинтез белков происходит на рибосомах (образуется первичный полипептид с определенной ДНК).
Снижение синтеза белка
|
ПРИЧИНЫ |
Белковое голодание, поражения печени (гепатит, цир- роз, токсико-инфекционные поражения, дефицит вита- мина К), наследственные нарушения В-системы. имму- нитета, дефицит анаболических гормонов (СТГ, инсу- лин, андрогены) |
|
МЕХАНИЗМЫ |
Дефицит и снижение активности ферментов анабо- лизма белка; уменьшение количества аминокислот |
|
ИЗМЕНЕНИЯ В ОРГАНИЗМЕ |
Гипопротеинемия, отеки, дистрофические процессы в клетках, нарушения иммунитета. Нарушения транспорта гормонов, нарушения гемостаза |
Увеличение синтеза белка обусловлено избыточной продукцией инсулина, андрогенов, соматотропина и является причиной формирования положительного азотистого баланса.
Нарушение азотистого равновесия
|
|
Азотистый баланс (азотистое равновесие) |
|
|
Положительный |
Отрицательный |
|
|
ПРИЧИНЫ |
Увеличение синтеза и, как следствие, уменьшение вы- ведения азота из организма (опухоли гипофиза, сетчатой зоны коры надпочечников) |
Преобладание распада белка в организме и, как следствие, выделение азота в большем количестве по сравнению с поступлением |
|
МЕХАНИЗМЫ |
Усиление синтеза и секреции гормонов, обеспечивающих синтез белка (инсулин, соматотропин, гормоны андрогенного действия) |
Увеличение продукции гормонов, стимулирующих катаболизм белка путем активации тканевых катепсинов (тироксин, глюко- кортикоиды) |
|
Последствия для организма |
Ускорение роста |
Дистрофия, в том числе, и желудочно-кишечного тракта, нарушения иммунитета |
Нарушения превращения аминокислот.
В процессе межуточного обмена аминокислоты подвергаются
ü трансаминированию (направлен на образование новых аминокислот путем переноса аминогруппы на кетокислоту; акцептором аминогрупп является α-кетоглютаровая кислота, которая превращается в глютаминовую)
ü дезаминированию (под влиянием ферментов аминооксидаз образуется аммиак и кетокислота, подвергающаяся дальнейшему превращению в цикле трикарбоновых кислот до СО2 и Н2О. При блокаде дезаминирования часть аминокислот подвергается декарбоксилированию с образованием ряда биологически активных аминов - гистамина, серотонина, α-аминомасляной кислоты, тирамина, дофамина и других)
ü декарбоксилированию (тормозится при гипертиреозе и избытке глюкокортикоидов)
49. Нарушение конечных этапов метаболизма белков. Расстройства связывания и выделения токсических продуктов азотистого обмена.
Азотемия (гиперазотемия) — избыточное содержание в крови азотсодержащих продуктов обмена белков и нуклеиновых кислот. К ним относятся мочевина, креатин, креатинин, мочевая кислота, индикан и др.
В зависимости от происхождения гиперазотемия подразделяется на продукционную (печеночную) и ретенционную (почечную).
|
|
ГИПЕРАЗОТЕМИЯ |
|
|
Печеночная (продукционная) |
Почечная (ретенционная) |
|
|
ПРИЧИНЫ |
Поражения печени (инток- сикации, цирроз, расстрой- ства кровообращения), белковое голодание |
Воспаление почек, рас- стройства кровообраще- ния, нарушения оттока мочи |
|
МЕХАНИЗМЫ |
Нарушение образования мочевины в печени |
Недостаточное выделе- ние азотистых продуктов с мочой |
|
ИЗМЕНЕНИЯ В ОРГАНИЗМЕ |
Последствия - нарушение функции органов и систем, особенно нервной системы. Возможно развитие пече- ночной или уремической комы. При нарушении обме- на мочевой кислоты развитие подагры |
|
|
Механизмы компенсации - Амидирование в клетках, аммониогенез в почках, выделение азотистых продук- тов альтернативными путями (через кожу, слизистые, желудочно-кишечный тракт) |
||
50. Основные проявления нарушения азотистого баланса, их механизмы.
|
|
Азотистый баланс (азотистое равновесие) |
|
|
Положительный |
Отрицательный |
|
|
ПРИЧИНЫ |
Увеличение синтеза и, как следствие, уменьшение вы- ведения азота из организма (опухоли гипофиза, сетчатой зоны коры надпочечников) |
Преобладание распада белка в организме и, как следствие, выделение азота в большем количестве по сравнению с поступлением |
|
МЕХАНИЗМЫ |
Усиление синтеза и секреции гормонов, обеспечивающих синтез белка (инсулин, соматотропин, гормоны андрогенного действия) |
Увеличение продукции гормонов, стимулирующих катаболизм белка путем активации тканевых катепсинов (тироксин, глюко- кортикоиды) |
|
Последствия для организма |
Ускорение роста |
Дистрофия, в том числе, и желудочно-кишечного тракта, нарушения иммунитета |
51. Нарушение расщепления и всасывания жиров. Причины, механизмы развития, последствия.
|
|
Нарушение гидролиза |
Нарушение всасывания |
|
ПРИЧИНЫ |
Поражения печени (гепатит, механическая и паренхима- тозная желтуха, нарушения кровообращения), поджелу- дочной железы, кишечника, (воспаление, некроз, опухо- ли), усиление перисталь- тики, прием антибиотиков (номицин, хлортетрациклин) |
Воспаление и расстройства кровообращения в кишечни- ке, недостаточность надпо- чечников, дефицит вит. А и В, избыток Са и Mg, отрав- ления флоридзином и мо- нойодацетатом + все при- чины, вызывающие наруше- ние гидролиза |
|
МЕХАНИЗМЫ |
Нарушения эмульгирования жиров, дефицит липазы поджелудочной железы и тонкого кишечника |
Нарушения транспорта и фосфорилирования жиров в кишечнике |
|
ИЗМЕНЕНИЯ В ОРГАНИЗМЕ |
Стеаторея (увеличенное вы- деление нерасщепленного жира с калом) |
Недостаточное поступление витаминов А, Д, Е, К. Нару- шение синтеза протромбина в печени. Дефицит ненасыщен- ных жирных кислот в орга- низме. Снижение жира в кро- ви и лимфе |
52. Гиперлипидемия. Виды, механизмы развития.
Гиперлипидемия - это диагностический синдром, который характеризуется аномально повышенным содержанием липидов или липопротеинов в крови.
Тип I. Это редкий тип гиперлипидемии, развивается при недостаточности липопротеинлипазы или дефекте в белке-активаторе липопротеинлипазы. При этом типе заболевания повышается уровень хиломикронов (липопротеины, которые переносят липиды из кишечника в печень). Гиперлипидемия усугубляется после приема жирной пищи и снижается после ограничения жиров, поэтому основное лечение - это назначение диеты.
Тип II. Распространенный тип гиперлипидемии, при котором повышается уровень липопротеинов низкой плотности. Подразделяется на два подтипа в зависимости от наличия высоких триглицеридов, которые при лечении требуют дополнительного назначения гемфиброзила. Гиперлипидемия этого типа приводит к развитию атеросклероза после 20-30 лет и может стать причиной инфаркта в возрасте 40-50 дет у мужчин и 55-60 лет у женщин.
Тип III. Тип гиперлипидемии, который еще называют дис-бета-липопротеиненией. Заболевание характеризуется наследственными причинами, и связан с дефектом Аполипопротеина E, а также характеризуется повышением уровня липопротеинов повышенной плотности. Носители гиперлипидемии склонны к ожирению, подагре, легкой форме сахарного диабета и входят в группу риска по атеросклерозу.
Тип IV. Тип гиперлипидемии, для которого характерна повышенная концентрация триглицеридов. Их уровень повышается после приема углеводов и алкоголя. На фоне этого синдрома может развиться атеросклероз, ожирение, сахарный диабет и панкреатит.
Тип V.
Тип гиперлипидемии, похожий на первый, но в отличие от него повышается
не только уровень хиломикронов, но и липопротеинов очень низкой
плотности. Поэтому, как и в случае с первым типом, содержание жиров в
крови подскакивает после приема жирной и углеводной пищи. Гиперлипидемия
этого типа чревата развитием тяжелого панкреатита, который развивается
на фоне приема слишком жирной пищи. Помимо этой классификации существуют
еще два типа гиперлипидемии - гипо-альфа-липопротеинемия и
гипо-бета-липопротеинемия.
53. Общее ожирение и его механизмы.
Ожирение – это заболевание, которое характеризуется повышением массы тела человека за счет увеличения объема или количества жировых клеток в организме.
Общее ожирение обусловлено усилением синтеза и торможением мобилизации жира из жировых депо. Во многом этому способствует снижение энергозатрат в условиях гиподинамии.
Синтез жира в жировых депо резко увеличивается при избыточном поступлении в организм жира и углеводов, чему способствует повышение аппетита и переедание. Показано, что в жировой ткани повышен липогенез, если пища принимается большими дозами. Лица с ожирением днем едят редко и мало, но зато вечером очень много, что получило название «синдрома ночного питания». Синтез жира требует достаточно большого количества инсулина, который тормозит активность липазы жировых клеток и жиромобилизующие эффекты контринсулярных гормонов.
Известно, что избыточное образование глюкокортикоидов (синдром или болезнь Иценко-Кушинга) также приводит к отложению жира в области туловища и лица. Это объясняется усилением секреции желудочного сока, повышением аппетита, что ведет к избыточному приему пищи. Кроме того, регионарность ожирения свидетельствует о роли расстройств гипоталамической области.
Развитие общего ожирения наблюдается при недостаточности гипофиза, щитовидной и половых желез, так как уменьшаются жиромобилизующие эффекты соматотропина, тироксина и половых гормо- нов.
54. Повышение мобилизации жира из депо, ожирение печени, нарушение превращения жирных кислот.
· Цикл глюкоза - жирная кислота. Увеличение концентрации глюкозы в крови ведет к торможению липолиза в жировой ткани. Снижение концентрации глюкозы крови способствует распаду жира и поступлению глицерина и жирных кислот в кровеносное русло
· Гипогликемия, а также дефицит инсулина, способствуют усиленному образованию катехоламинов, глюкагона, глюкокортикоидов, которые, как и вазопрессин, активируют липазу.
· Торможение липолиза отмечено также при действии на организм а и β-симпатолитиков, никотиновой и нук- леиновых кислот, салицилатов.
· Мобилизация жира из жировых депо происходит при дефиците углеводов как важнейшего энергетического субстрата (сахарный диа- бет, углеводное голодание), что ведет к усиленному образованию и превалированию эффектов вазопрессина.
Нарушение превращения жирных кислот
Жирные кислоты поступают в кровь из пищи и из жировых депо, а также при гид-ролизе β-липопротеинов печени. Основная масса жирных кислот доставляется в печень, где используется для ресинтеза триглицеридов, а последние входят в состав более сложных липидов — β- липопротеинов. Последние вне печени через образование ацетилКоА используются в цикле Кребса как энергетический материал с образованием конечных продуктов - СО2 и Н2О.
При дефиците углеводов, усиливается образование катехоламинов, глюкагона и др. и мобилизация жира из жировых депо. Жирные кислоты поступают в печень, где интенсивно используются (в условиях дефицита углеводов) как основной энергетический материал. Резко возрастает количество холестерина и кетоновых тел (ацетон, ацетоуксусная и β-оксимасляная кислоты). Использование ацетоновых тел в цикле Кребса в органах возрастает, но количество их в крови остается повышенным. Это явление получило название кетоза.
Таким образом, в результате нарушения превращения жирных кислот развиваются явления гиперхолестеринемии и кетоза
Ожирение печени
Мобилизация жира из печени происходит в виде β-липопротеинов. Контролируется этот процесс липокаином, вырабатываемым в мелких протоках поджелудочной железы. Кроме этого, важное значение в мобилизации β- липопротеинов из печени принадлежит фосфолипидам, для образования которых необходим метионин и холин.
55. Роль свободно-радикального окисления липидов в патологии
Необходимым звеном жизнедеятельности любой клетки является пероксидное окисление липидов (ПОЛ). Данный механизм лежит в основе обновления и перестройки биологических мембран, регуляции их состава, проницаемости и активности мембранносвязанных ферментов. ПОЛ - это физиологический процесс, обеспечивающий в организме фаго- и пиноцитоз, синтез простагландинов, лейкотриенов, холестерина, прогестерона
По своей химической природе ПОЛ - это вариант свободнорадикального окисления (СРО), реакциям которого подвержены все без исключения соединения, однако наиболее чувствительны к СРО липиды: в первую очередь, ненасыщенные жирные кислоты (НЖК), как свободные, так и в составе фосфолипидов (ФЛ).
Высокая биологическая активность различных продуктов пероксидного окисления липидов, а также других различных интермедиатов кислорода обусловила необходимость постоянного функционирования в организме специальных механизмов противоокислительной (антиоксидантной) биологической защиты.
56. Нарушение обмена холестерина. Гиперхолестеринемия. Роль нарушений липидного обмена в патогенезе атеросклероза.
Холестерин

входит в состав всех липопротеиновых фракций крови. Больше всего его в β-липопротеинах. В крови человека содержится 150- 250 мг % (3,9-6,5 ммоль/л) холестерина. Синтез холестерина происходит почти во всех тканях, но больше всего в кишечнике и печени. При избыточном поступлении пищевого холестерина синтез его в печени тормозится по принципу обратной связи. Повышение синтеза холестерина в печени наблюдается при отсутствии желчных кислот. При их дефиците синтез холестерина в слизистой тонкой кишке увеличивается в 5-10 раз.
Основное влияние на уровень холестерина оказывает содержание жира, особенно ненасыщенных жирных кислот в пище.
Гиперхолестеринемия – это повышенное содержание холестерина в крови (свыше 200 мг/дл или 5,18 ммоль/л).
Этиология первичной гиперхолестеринеми неизвестна
Этиология вторичной гиперхолестеринеми
- Гипотиреоз.
- Сахарный диабет.
- Нефротический синдром.
- Обструктивные заболевания печени.
- Приём некоторых препаратов
Атеросклероз — это хроническое заболевание кровеносных сосудов, при котором на внутренней стенке артерий откладываются холестерин и другие жиры в форме налетов и бляшек, а сами стенки уплотняются и теряют эластичность.
Главная роль в развитии атеросклероза принадлежит липопротеинам низкой плотности (ЛПНП), которые осуществляют транспорт холестерина из печени в клетки, его должно быть строго необходимое количество, по превышению его уровня определяют риск возникновения атеросклероза.
Обратный транспорт холестерина из тканей в печень обеспечивают липопротеины высокой плотности (ЛПВП) – это антиатерогенный класс липопротеинов. Он очищает поверхность клеток от избытка холестерина. Повышение уровня холестерина ЛПНП и понижение уровня холестерина ЛПВП увеличивает риск возникновения и развития атеросклероза.
59. Нарушения электролитного обмена
Гипонатриемия — снижение концентрации натрия в крови до 135 ммоль/л и ниже,
Гиперкальциемия (содержание
кальция в крови выше 2,63 ммоль/л).
Гипокалиемия — уменьшение концентрации калия в крови ниже 3,5
ммоль/л.
Гиперкалиемия — увеличение концентрации калия выше 5,5 ммоль/л.
Гипомагниемия — снижение уровня магния ниже 0,5 ммоль/л.
|
|
Основными причинами
нарушений водно-электролитного баланса являются
внешние потери жидкостей и патологические перераспределения их между
главными жидкостными средами.
Основными причинами гипокальциемии являются:
— травма паращитовидных желез;
— терапия радиоактивным йодом;
— удаление паращитовидных желез;
— псевдогипопаратиреоз.
Наиболее частая причина гиперкальциемии —
первичный или вторичный гиперпаратиреоз.
К основным причинам гипонатриемии относят:
— тяжелые изнуряющие болезни,
сопровождающиеся снижением диуреза;
— посттравматические и послеоперационные
состояния;
— внепочечные потери натрия;
— избыточное поступление воды в
антидиуретическую фазу посттравматического или послеоперационного
состояния;
— бесконтрольное применение диуретиков.
Причинами гипокалиемии являются:
— смещение калия в клетки;
— превышение потерь калия над его
поступлением сопровождается гипокалийгистией;
— сочетание указанных выше факторов;
— алкалоз (респираторный,
метаболический);
— альдостеронизм;
— периодический гипокалиемический паралич;
— применение кортикостероидов.
Основными причинами гиперкалиемии являются:
— выход калия из клетки вследствие ее
повреждения;
— задержка калия в организме, чаще всего
изза избыточного поступления катитона в организм пациента.
Причинами гипомагниемии может
быть:
— хронический
алкоголизм;
— поражение печени;
— резекция тонкой кишки;
— диарея,
наличие свищей;
— гипопаратиреоз;
— введение инсулина.
60. Основные механизмы формирования отека
Отек - патологическое скопление жидкости в тканях и межтканевых пространствах вследствие нарушения обмена воды между кровью и тканями. Отек - типовой патологический процесс, встречающийся при многих заболеваниях.
В зависимости от основного патогенетического фактора различают гидродинамический, лимфогенный, онкотический, осмотический и мембраногенный отёки.
I. Гидродинамический (гемодинамический, гидростатический, механический) фактор характеризуется увеличением эффективного гидростатического давления.
Причины:
1. Повышение венозного давления
2.Увеличение ОЦК (например, при гиперволемии, полицитемии, водном отравлении).
Механизмы реализации гидродинамического фактора:
-Увеличение фильтрации жидкости в артериальной части капилляра вследствие повышения эффективного гидростатического (следовательно - фильтрационного) давления.
-Снижение тургора тканей. Тургор характеризует напряжённость, эластичность ткани.
I. Лимфогенный (лимфатический) фактор характеризуется затруднением оттока лимфы от тканей вследствие либо механического препятствия, либо избыточного образования лимфы.
Причины -Врождённая гипоплазия лимфатических сосудов и узлов.
-Сдавление лимфатических сосудов (например, опухолью, рубцом, гипертрофированным соседним органом).
-Эмболия лимфатических сосудов (например, клетками опухоли, фрагментами тромба, паразитами, последнее нередко наблюдается при попадании в лимфатические сосуды филярий).
-Опухоль лимфоузла (например, лимфома или лимфосаркома), а также метастазы опухолей других тканей и др.
Механизмы
-Динамическая лимфатическая недостаточность.
-Механическая лимфатическая недостаточность. Она является следствием механического препятствия оттоку лимфы по сосудам в результате их сдавления или обтурации.
II. Для онкотического (гипоальбуминемического, гипопротеинемического) фактора развития отёка характерно снижение онкотического давления крови и/или увеличение его в межклеточной жидкости.
Причины:
1. Снижающие онкотическое давление крови в результате гипопротеинемии.
2. Повышающие онкотическое давление интерстициальной жидкости.
Механизм реализации онкотического фактора заключается в уменьшении эффективной онкотической всасывающей силы (как следствие гипопротеинемии и/или гиперонкии ткани).
III. Осмотический фактор развития отёка заключается либо в повышении осмоляльности интерстициальной жидкости, либо в снижении осмоляльности плазмы крови, либо в сочетании того и другого.
Причины включения осмотического фактора отёка:
-Факторы, снижающие осмотическое давление крови: парентеральное введение больших объёмов растворов, содержащих соли в недостаточном количестве.
-Факторы, повышающие осмоляльность интерстициальной жидкости: выход из повреждённых или разрушенных клеток осмотически высокоактивных веществ (например, ионов Na+, K+, Ca2+, глюкозы, МК, азотистых соединений
Механизм
избыточный транспорт воды из клеток и сосудов микроциркуляторного русла в межклеточную жидкость по градиенту осмотического давления (более высокого в интерстиции).
IV. Мембраногенный фактор характеризуется существенным повышением проницаемости стенок сосудов микроциркуляторного русла для воды, мелко‑ и крупномолекулярных веществ (наибольшее значение среди последних имеют белки).
Механизмы реализации мембраногенного фактора развития отёка:
-Облегчение фильтрации воды. В связи с этим увеличивается выход жидкости из крови и лимфы в интерстициальное пространство.
-Увеличение выхода молекул белка из микрососудов в межклеточную жидкость. Это ведёт к снижению онкотического давления плазмы крови и лимфы и одновременно к развитию гиперонкии межклеточной жидкости.
61. Голодание и его причины. Социальные причины голода. Изменение обмена веществ и физиологических функций при голодании.
Голодание — это состояние, которое формируется в результате недостаточного поступления в организм питательных веществ, необходимых для нормального течения обмена веществ и покрытия энергетических затрат.
Причины
стихийных бедствий, например, землетрясения, наводнения
болезнь, особенно при таких заболеваниях, как инфекционные, поражения желудочно-кишечного тракт
в лечебных целях (например, при лечении ожирения, заболеваний пищеварительного тракта и др.).
Выделяют следующие виды голодания:
- абсолютное, или полное прекращение поступления в организм пищи и воды;
- полное — полное прекращение приема пищи при сохранении приема воды;
- неполное, или недоедание, когда калорийность принимаемой пищи (полноценной по составу) не покрывает всех энергетических затрат и пластических нужд организма;
- частичное, или качественное, когда калорийность пищи сохраняется, но в составе пищи отсутствуют или недостаточно поступают те или иные питательные вещества (белки, жиры, углеводы, витамины и т.п.).
Полное голодание
- начальный (приспособительный), продолжительностью 4—5 сут;
- стационарный (наибольшего приспособления). продолжительностью 55 — 60 сут;
- терминальный (заключительный), продолжительностью 2 — 3 сут.
В первый период происходит увеличение основного обмена. В течение первых суток энергетические потребности организма в основном обеспечиваются за счет окисления резервных углеводов. Дыхательный коэффициент равен 1,0. В первые сутки отмечается и наибольшая потеря массы тела. Начиная со вторых суток, энергозатраты организма в основном (на 84%) покрываются окислением жиров. Синтез белка снижается, одновременно усиливается его распад, что ведет к возникновению отрицательного азотистого баланса.
Во второй период организм человека адаптируется к голоданию и полностью перестраивает ферментные системы для перехода к эндогенному питанию. Основной обмен понижается. В этот период мобильные резервы углеводов оказываются исчерпанными. Энергетические затраты на 90 % обеспечиваются за счет распада жиров и окисления жирных кислот. Дыхательный коэффициент падает (около 0,7). Нарастает кетонемия с последующим появлением кетоновых тел в моче. В связи с этим возникает и постепенно развивается ацидоз (компенсированный).
Значительные изменения претерпевает моторика и секреторная функция желудка и кишечника. Вначале их моторика резко усилена (голодная моторика), а затем ее интенсивность резко снижается. Выделение пищеварительных соков увеличиваетсяВ целом основные жизненные функции организма (температура тела, артериальное давление, частота пульса, уровень сахара в крови и др.) остаются в пределах нижней границы нормы.
В основе третьего периода полного голодания лежат расстройства ферментных систем, приводящие к нарушениям большинства функций организма.
65. Нарушение обмена веществ и физиологических функций при гипоксии.
Гипоксия - типовой процесс, возникающий при недостаточном снабжении тканей кислородом или нарушении его утилизации в процессе биологического окисления.
Наиболее ранние изменения при гипоксии возникают в сфере углеводного и энергетического обмена, которые особенно тесно связаны с биологическим окислением.
Условно можно выделить следующие этапы нарушения обмена веществ при гипоксиях:
1. Снижение концентрации АТФ и увеличение АДФ, АМФ и Фн, следовательно увеличение потенциала фосфорилирования АДФ + Фн/АТФ. В некоторых тканях (головной мозг, кардиомиоциты) отмечается более раннее снижение содержания КФ.
2. Усиление гликолиза и, следовательно, падение концентрации гликогена и увеличение концентрации пирувата и лактата.
3. Метаболический ацидоз.
4. Угнетение биосинтеза нуклеиновых кислот и белка, усиление их распада вследствии активации лизосомальных протеаз и нуклеаз под влиянием ацидоза и, следовательно отрицательный азотистый баланс.
5. Угнетение ресинтеза жиров, усиление липолиза ,следовательно, гиперкетонемия, следовательно, усиление ацидоза. Кроме того, кроме того накопление жирных кислот в клетках, что приводит к снижению эффективности биологического окисления в митохондриях, а это усугубляет дефицит энергии.
6. Гиперкалиемия, так как дефицит натри-кали-зависимой АТФ-азы.
7.Дефицит Са-зависимой АТФ-азы приводит к накоплению Са в цитоплазме и митохондриях, что еще больше снижает эффективность биологического окисления.
8. Активация ПОЛ вследствии:
9. Дестабилизация цитоплазматической мембраны и мембраны органелл (СПР, лизосом, митохондрий).
10. Выход лизосомальных ферментов приводит к гипоксической альтерации клеток вплоть до необратимых изменений и гибели.
67. Механизмы долговременной адаптации к гипоксии
Долговременные компенсаторные реакции возникают при хронической гипоксии, наблюдаемой при различных заболеваниях, при специальных тренировках к недостатку кислорода или жизни человека в высокогорных условиях. Они формируются на путях транс- порта и утилизации кислорода.
· Дыхательный аппарат - увеличение диффузионной поверхности легких
· сердечно-сосудистой система — это компенсаторная гипертрофия сердца,увеличение количества эритроцитов и гемоглобина и, следовательно, объема циркулирующей крови, за счет активации эритропоэза в костном мозге.
· На уровне тканей долговременная компенсация проявляется увеличением массы митохондрий на единицу массы клетки и, следовательно, улучшением утилизации кислорода.
68. Патофизиологические основы профилактики и терапии к гипоксии.
1. Улучшающие доставку кислорода к тканям и его утилизацию за счет стимуляции дыхания, кровообращения (аналептики, кардио- тонические средства), усиление эритропоэза. Стимулирующие средства наиболее эффективны при не тяжелом кислородном голодании.
2. Вещества, повышающие устойчивость организма к гипоксии за счет снижения потребления кислорода (наркотические, снотворные, транквилизаторы, антиадренэргические средства).
3. Средства, способствующие сохранению или образованию макроэргов:
а) вещества с электронно-акцепторными или электронно- донаторными свойствами (цитохром С, НАД, НАДФ, аскорбиновая кислота, глютатион, цистеин, АТФ, АДФ, АМФ);
б) вещества, активирующие ферментные и коферментные системы (кокарбоксилаза, никотинамид, тиамин, аскорбиновая кислота, аминокислоты типа метионина, триптофана, цистеина), вещества, содержащие тиоловые группы (глютатион, унитиол), производные пи- римидина (пентоксил, метацил);
в) АТФ или фосфорилированные углеводы (глюкозо-1-фосфат, глюкозо-6-фосфат, фруктозо-1,6-фосфат) способствуют пополнению и сохранению АТФ, которая обычно используется для фосфорилиро- вания глюкозы.
4. Средства, нормализующие мембраны клеток, рН, электро- литный обмен. Учитывая, что при гипоксии развиваются мета- болический ацидоз и внутриклеточные изменения калия, назначают ощелачивающие вещества и хлористый калий. Стабилизация мембран клеток достигается назначением глюкокортикоидов и хлористого маг- ния.
В настоящее время важным фактором профилактики и лечения гипоксии является гипербарическая оксигенация.
69. Нарушение в системе факторов естественной резистентности и их связь с иммунологической реактивностью. Патология фагоцитоза.
Специфическая реактивность - это способность организма отвечать на действие антигена выработкой антител или комплексом клеточных реакций, специфичных по отношению к этому антигену, т.е. это реактивность иммунной системы (иммунологическая реактивность).
Иммунитет обеспечивает резистентность организма к действию, прежде всего, инфекционных факторов. При снижении интенсивности иммунитета и развитии иммунодефицита, врожденного или приобретенного, резистентность организма к действию микробов и вирусов понижается.
При накоплении в крови иммуноглобулинов IgE, IgG, IgM резко повышается чувствительность организма и развиваются аллерги- ческие реакции.
Наоборот, при вакцинации повышается резистентность к дей- ствию соответствующих инфекционных раздражителей.
Фагоцитоз – это разновидность клеточного иммунитета, характеризующаяся распознаванием, поглощением и перевариванием фагоцитами различных чужеродных корпускулярных объектов.
Различают фагоцитоз внутрисосудистый и тканевый, завершенный и незавершенный.
Стадии фагоцитоза:
I – приближение фагоцита к объекту фагоцитоза;
II – прилипание;
III – поглощение объекта фагоцитом;
IV – умерщвление жизнеспособных объектов (стадия киллинга);
V – переваривание нежизнеспособных объектов.
Причины патологии фагоцитоза
1. Уменьшение количества фагоцитов (прежде всего нейтрофильных лейкоцитов, возникает при лейкопениях врожденного и приобретенного характера)
2. Структурно-функциональные изменения фагоцитов врожденного и приобретенного характера:
1) нарушением сократительных структур фагоцита;
2) изменением структуры рецепторов, чувствительных к хемотаксическим веществам и опсонинам;
3) снижением активности ферментов, осуществляющих нормальный метаболизм фагоцитов, в частности энергетический;
г) дефектами бактерицидных систем фагоцитов.
3. Изменения гормонально-гуморальной регуляции процесса фагоцитоза и др.
1) врожденная или приобретенная недостаточность различных компонентов комплемента, в частности Clr, Cl, C3 – 8;
2) врожденные или приобретенные иммунодефицитные состояния по Т– и В-системам лимфоцитов, которые сопровождаются дефицитом IgG, IgM, IgA.
73. Сенсибилизация и ее механизмы при аллергии немедленного типа
Сенсибилизация - процесс увеличения чувствительности организма к веществам антигенной природы, заключающийся в избыточной продукции антител (иммуноглобулинов или Т-лимфоцитов).
Обработанные макрофагом молекулы антигена передаются соответствующему по иммуноглобулиновым рецепторам (антиген специфичному) В-лимфоциту. Происходит пролиферация В-лимфоцитов и превращение их в большие бластные клетки, которые после деления дают поколение плазматических клеток-продуцентов антител. С соединения этих антител с повторно попавшим в организм аллергеном и будет начинаться процесс немедленного типа.
В зависимости от вида антител, образовавшихся в процессе сенсибилизации их можно разделить на две группы:
1. Антитела, участвующие в аллергии немедленного типа:
1) Реагины (иммуноглобулины класса Е). Они обладают свойством соединяться с тучными клетками рыхлой соединительной ткани, с базофильными гранулоцитами крови и с аллергеном.
2) Цитотоксические антитела – лизины. Они реагируют с аллергеном на поверхности клеточной мембраны, а после её повреждения могут могут проникнуть внутрь клетки.
3) Антитела преципитины. Они образуют растворимые комплексы с аллергеном в жидкостях организма. Этот комплекс способен связывать и активировать систему комплемента.
2. Антитела, препятствующие аллергическим явлениям.
1) Блокирующие антитела-одновалентные, они реагируют специфически и только с одной молекулой аллергена, после чего он не может участвовать в образовании патогенных агрегатов и не может вызвать аллергический процесс. Эти антитела образуются, когда ингаляционные аллергены (кожи, пыльцы растений) вводятся в организм путём инъекций.
2) Секреторные иммуноглобулины класса А. Они накапливаются на поверхности эпителия, сообщающегося с внешней средой и препятствуют проникновению инфекционных и других антигенов.
74. Сенсибилизация и ее механизмы при аллергии замедленного типа
Сенсибилизация - процесс увеличения чувствительности организма к веществам антигенной природы, заключающийся в избыточной продукции антител (иммуноглобулинов или Т-лимфоцитов).
Аллерген, попавший в лимфатический орган (региональный лимфатический узел, селезёнку) фагоцитируется и обрабатывается макрофагом (поглощается, дробится) и вновь возвращается на поверхность клетки, где и распознаётся Т-лимфоцитом, на поверхности которого имеются специфические рецепторы. В результате запускается процесс пролиферации Т-лимфоцитов, они превращаются в большие бластные клетки, которые делятся и из них образуется много Т-л-эффекторов, способных соединяться с данным аллергеном. Среди них выделяют Т-лимфоциты секреторы, выделяющие БАВ-лимфокины и Т-лимфоциты-киллеры, а также долгоживущие лимфоциты-клетки памяти, которые обеспечивают вторичный, более быстрый, иммунологический ответ. Кроме них в процессе сенсибилизации участвуют Т-л супрессоры, которые могут подавлять развитие аллергии (замедленного и немедленного типа), Т-лимфоциты хелперы, активизирующие В-лимфоциты, Т-л-амплифаеры-усилители. Возникает аллергия замедленного типа.
79. Клинические стадии шока
Шок (удар, потрясение) — патологический процесс, развивающийся в ответ на воздействие чрезвычайных раздражителей и сопровождающийся прогрессивным нарушением жизненно важных функций нервной системы, кровообращения, дыхания, обмена веществ и других функций.
|
Показатель |
Эректильная фаза (Фаза возбуждения) |
Торпидная фаза (фаза торможения) |
|
АД |
повышение |
Снижение |
|
Окраска кожи |
бледная |
Бледная с синюшным оттенком |
|
Пульс |
учащен |
учащен |
|
Состояние ЦНС |
Возбуждение |
Торможение |
|
Зрачки |
расширение |
|
|
Температура кожи |
Не изм |
снижение |
|
Выделение мочи |
олигурия |
Олиго-анурия |
|
Частота дыхания |
Увеличение |
увеличение |
|
Ацидоз |
Нет |
есть |
|
Уменьшение секреции и моторики ЖКТ |
Естьъ |
есть |
80. Патогенетическая классификация ведущих звеньев патогенеза шоковых состояний.
Шок (удар, потрясение) — патологический процесс, развивающийся в ответ на воздействие чрезвычайных раздражителей и сопровождающийся прогрессивным нарушением жизненно важных функций нервной системы, кровообращения, дыхания, обмена веществ и других функций.
1. Травматический и геморрагический шок. Наблюдается при тяжелой механической травме, кровопотере, оперативных вмешательствах (при недостаточном наркозе). Н-р, при тяжелых травмах в результате несчастных случаев, автомобильных катастроф и т.д.
2. Кардиогенный шок наблюдается при инфаркте миокарда или тяжелой и длительной стенокардии. Возникающие при этом ишемия и гипоксия миокарда являются причинами сильнейшего болевого синдрома и резкого снижения сократительной способности миокарда.
3. Шок при действии физических факторов - высокой и низкой температуры (ожоговый и холодовой шок). Тепло и холод вызывают чрезвычайно сильное раздражение рецепторных образований нервной системы и афферентацию. Характерны острая плазмопотеря и гемолиз эритроцитов, почечная недостаточность и развивается анурия.
4. Анафилактический, гемотрансфузионный, анафилактоидный шок. Основной причиной первых двух является иммунологический конфликт. Гемотрансфузионный шок связан с переливанием несовместимой крови.
5. Септический или токсико-инфекционный шок наблюдается при тяжелых инфекционных процессах (сепсисе, пневмонии).
81. Нейро-эндокринные нарушения при шоке
Шок (удар, потрясение) — патологический процесс, развивающийся в ответ на воздействие чрезвычайных раздражителей и сопровождающийся прогрессивным нарушением жизненно важных функций нервной системы, кровообращения, дыхания, обмена веществ и других функций.
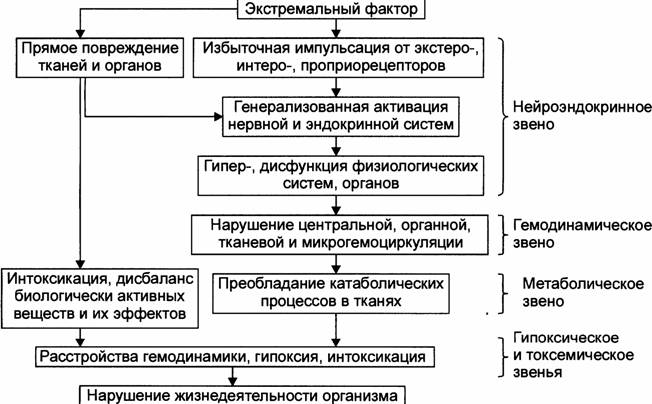
Пусковым механизмом возникновения шока является чрезмерные импульсы, идущие от рецепторов в головной мозг. Они может быть болевыми(из места первичного повреждения тканей) и неболевыми (за счет раздражения рецепторов органов и тканей вследствие нарушений кровообращения, гипоксии, расстройств метаболизма).
Возбуждение центральных аппаратов нервной системы приводит к активации ряда эндокринных систем - симпато-адреналовой и гипоталамо-гипофизарно-адренокортикальной ---- увеличение содержания в крови катехоламинов, кортикостероидных гормонов, вазопрессина; активируется ренин-ангиотензин-альдостероновая система ----- сужение периферических сосудов, в том числе прекапиллярных сфинктеров за счет активации, α-адренорецепторов. Генерализованный спазм сосу- дов не наблюдается. Учащается ритм сердца, которое достигается путем стимуляции β-адренорецепторов --- увеличение ударного и минутного объема сердца. У больных увеличенной речевой и двигательной активностью, жалобами на сильные боли, повышением рефлексов, расширением зрачков, учащением пульса, повышением системного артериального давления. Кожные покровы бледные вследствие интенсивного сосудистого спазма. Сознание сохранено.
82. Нарушение системной гемодинамики и микроциркуляции при шоке.
Шок (удар, потрясение) — патологический процесс, развивающийся в ответ на воздействие чрезвычайных раздражителей и сопровождающийся прогрессивным нарушением жизненно важных функций нервной системы, кровообращения, дыхания, обмена веществ и других функций.
Механизмы нарушений общей гемодинамики и микроциркуляции при шоке
І. Уменьшение объёма циркулирующей крови: 1) кровопотеря (геморрагический шок); 2) потеря плазмы крови при обширном экссудативном воспалении (ожоговый шок); 3) выход жидкости из кровеносных сосудов (анафилактический шок); 4) обезвоживание (ангидремический шок); 5) перераспределение крови в сосудистом русле (тромбоз и эмболия магистральных вен).
ІІ. Уменьшение минутного объёма сердца: 1) нарушение сократительной функции сердца (инфаркт миокарда); 2) тампонада сердца (разрыв сердца, экссудативный перикардит); 3) аритмии (фибрилляция желудочков).
ІІІ. Уменьшение общего периферического сопротивления в результате генерализованного расширения сосудов: 1) падение нейрогенного тонуса артериол (болевые формы шока); 2) уменьшение базального тонуса сосудов под действием биологически активных веществ (анафилактический, панкретический шок) или токсических продуктов (травматический, турникетный, инфекционно-токсический шок).
ІV. Нарушения реологических свойств крови: 1) синдром внутрисосудистого диссеминированного свёртывания крови (панкреатический шок); 2) агрегация форменных элементов крови (септический, инфекционно-токсический шок); 3) сгущение крови – гемоконцентрация (ангидремический шок).
83. Метаболический нарушения при шоке. Необратимые изменения. Понятие «травматической болезни».
Шок (удар, потрясение) — патологический процесс, развивающийся в ответ на воздействие чрезвычайных раздражителей и сопровождающийся прогрессивным нарушением жизненно важных функций нервной системы, кровообращения, дыхания, обмена веществ и других функций.
Метаболические нарушения возникают сразу после травмы из-за циркуляторных расстройств, изменений кислородного режима, расстройств нейроэндокринной регуляции. Особенно большую роль играют расстройства углеводного обмена, проявляющиеся избыточным образованием лактата. В норме его в крови 9-16 мг/% (0,99-1,77 ммоль/л), при шоке лактата может быть 24,3-30,6 мг/% (2,7-3,4 ммоль/л).
Поскольку шок проявляется нарастанием процессов катаболизма (процесс метаболического распада), в том числе катаболизма белков, важное значение может иметь определение креатин-креатинового индекса при шоке:
1. креатин + креатинин - в норме индекс = 1,0, при легком шоке = 1,5.
2. креатинин -
при тяжелом = 2,0 и выше.
Шок особенно тяжело протекает у детей и лиц пожилого и старческого
возраста
Необратимые изменения при шоке связанны с неконтролируемой воспалительной реакцией.
В норме одновременно с воспалением действуют и ограничивающие его механизмы. Однако если воздействие, вызывающее воспаление, очень сильное или длительное, то аутокринные клеточные реакции (Клетка-мишень сама является клеткой, генерирующей гормональный сигнал, те аутокринное действие клеток - самостимулирующее действие) и паракринные клеточные реакции (Действие гормона воспринимают соседние клетки) начинают развиваться по типу порочного круга. Активация эндотелиальных клеток ведет к синтезу молекул адгезии (молекул-сцепления) цитокинов (информационных молекул) . При шоке этот выброс становится чрезмерным и неконтролируемым. Адгезия нейтрофилов и макрофаговведет к их избыточной активации и выделению большого количества медиаторов воспаления.
Травматическая болезнь– это совокупность общих и местных патологических сдвигов в организме при повреждении органов и тканей, приводящих к нарушению гомеостаза.
В течение ТБ выделяются 4 периода.
1-й период (острый) - период острого нарушения жизненно важных функций.
-травматического шока или терминального состояния
- травматической комы при тяжелых повреждениях головного мозга
- дыхательная недостаточность при тяжелых повреждениях груди
- острой сердечной недостаточности при повреждении сердца. Он начинается сразу же после травмы и продолжается 6-12 ч в зависимости от тяжести травмы и эффективности лечебных мероприятий
|
|
2-й период - период относительной стабилизации жизненно важных функций. В этот период формальные показатели жизненно важных функций (АД, пульс, напряжение кислорода в крови, показатели крови) приближаются к нормальным значениям или отклоняются незначительно, но компенсация функций неустойчива, возможны срывы. Этот период
продолжается от 12 до 48 ч
3-й период - период максимальной вероятности развития осложнений.
В этот период создаются оптимальные условия для развития осложнений. Вследствие большой кровопотери, эндотоксикоза, ДВС-синдро-ма, системного воспалительного ответа во внутренних органах (легкие, сердце, селезенка, печень, кишечник, почки) сформировалисьмножественные очаги микротромбозов.
|
|
Особенно благоприятные условия для развития тяжелых осложнений создаются в легких.
4-й период ТБ - период полной стабилизации жизненно важных функций. В этот период все показатели жизненно важных функций восстанавливаются до нормальных значений или близких к ним. Временных параметров для этого периода не существует.
84. Общие принципы лечения шока
Шок (удар, потрясение) — патологический процесс, развивающийся в ответ на воздействие чрезвычайных раздражителей и сопровождающийся прогрессивным нарушением жизненно важных функций нервной системы, кровообращения, дыхания, обмена веществ и других функций.
В эректильной фазе шока (наблюдается возбуждение нервной, симпатоадреналовой, гипоталамо-гипофизарно-надпочечниковой, сердечно-сосудистой систем и повышение системного артериального давления)
· необходима первичная обработка места травмы с соблюдением правил асептики и антисептики
· остановка кровотечения
· снижение болевой импульсации путем новокаиновой блокады
· применения аналгетиков --- уменьшение болевого и эмоционального компонентов стресса, уменьшение вовлечения кардиального и сосудодвигательного центров и нивелирование выраженности расстройств системной гемодинамики и микроциркуляции.
В торпидной фазе шока лечение направлено на восстановление объема циркулирующей крови (переливание крови, плазмы или плазмозаменителей), системного артериального давления, микроциркуляции, эндокриннообменных расстройств, нормализацию кислотно-основного равновесия, функции нервной системы, дыхания, сердца, почек. Переливание плазмо- и кровезаменителей обеспечивает увеличение венозного возврата крови к сердцу, повышение ударного и минутного объема сердца --- нормализацию системного артериального давления.
Использование вазоактивных веществ (повышает общее периферическое сопротивление, увеличивает ударный и минутный объемы кровообращения и нормализует системное артериальное давление).
Наличие резко выраженной гипоксии требует назначения антигипоксантов (корректор микроциркуляции).
Используют гормоны. Глюкагон (увеличение минутного объема сердца и системного артериального давления), Глюкокортикоиды (компенсируют надпочечниковую недостаточность, стабилизируют мембраны клеток, предотвращая поступление ферментов в кровь, снижают уровень вазоактивных веществ).
85. Стресс. Этиология, стадии, общий патогенез стресса
Стресс — совокупность неспецифических адаптационных (нормальных) реакций организма на воздействие различных неблагоприятных факторов–стрессоров(физических или психологических), нарушающее его гомеостаз, а также соответствующее состояние нервной системы организма (или организма в целом).
Стресс проявляется в виде общего адаптационного синдрома, который состоит из 3-х последовательных стадий:
I. реакция тревоги - немедленную мобилизацию защитных сил организма. Она состоит из
1. фазы шока (гипотония мышц, артериальная гипотензия, гипотермия, гипогликемия, сгущение крови, повышение проницаемости капилляров)
2. противошока (повышение АД, мышечного тонуса, содержания глюкозы в крови, ведут к стадии резистентности). Основное патогенное звено фазы противошока – стойкое усиление секреции кортикотропина и кортикостероидов.
II. стадии резистентности (гипертрофируется корковое вещ-во надпочечников и секретируется большое количество гормонов, активизирующих анаболические процессы, усиливается гликонеогенез)
III. стадии истощения (При длительном действии повреждающего агента адаптация нарушается → истощение функциональных резервов → истощение коркового вещества надпочечников → стадия истощения (дистресс).
Исход стресса зависит от соотношения силы и длительности действия стрессора и потенциальных возможностей защитных сил организма.
Виды стресса
По биологической значимости стресс можно разделить на адаптивный и патогенный.
86. Нарушения в оргнизме при стрессе
Стресс сопровождается функциональными и морфологическими изменениями. Доказана роль стресса как главного этиологического фактора язвенных поражений слизистой желудка,гипертонической болезни,атеросклероза,нарушений структуры и функции сердца,формирование злокачественных опухолей,нарушения обмена веществ.
Патогенез язв желудка при стрессе.У человека формирование язв наблюдается при стрессе,вызванном конфликтом между необходимостью осуществлять пищевую,половую,оборонительны реакции и запретом или невозможностью их осуществления.
Нарушения сердечно-сосудистой системы при стрессе. Активация при стрессе симпато-адреналовой системы вызывает учащение ритма сердечных сокращений,увеличение периферического сопротивления,следствием которых является подъём системного артериального давления.
Влияние стресса на иммунитет. В стадии тревоги действи стресса и особенно в условиях действия экстримальных факторов отличается торможение иммунобиологических механизмов,следствием чего обычно является уменьшение интенсивности аллергических реакций ,снижение резистентности к опухолевому росту,повышение чувствительности к вирусным и бактериальным инферкциям.
87. Роль стресса в возникновении патологических процессов и заболеваний
Стресс — совокупность неспецифических адаптационных (нормальных) реакций организма на воздействие различных неблагоприятных факторов–стрессоров(физических или психологических), нарушающее его гомеостаз, а также соответствующее состояние нервной системы организма (или организма в целом)
Стресс проявляется в виде общего адаптационного синдрома, который состоит из 3-х последовательных стадий:
IV. реакция тревоги - немедленную мобилизацию защитных сил организма. Она состоит из
3. фазы шока (гипотония мышц, артериальная гипотензия, гипотермия, гипогликемия, сгущение крови, повышение проницаемости капилляров)
4. противошока (повышение АД, мышечного тонуса, содержания глюкозы в крови, ведут к стадии резистентности). Основное патогенное звено фазы противошока – стойкое усиление секреции кортикотропина и кортикостероидов.
V. стадии резистентности (гипертрофируется корковое вещ-во надпочечников и секретируется большое количество гормонов, активизирующих анаболические процессы, усиливается гликонеогенез)
VI. стадии истощения (При длительном действии повреждающего агента адаптация нарушается → истощение функциональных резервов → истощение коркового вещества надпочечников → стадия истощения (дистресс).
Исход стресса зависит от соотношения силы и длительности действия стрессора и потенциальных возможностей защитных сил организма.
88. Понятие об опухолях. Этиология опухолей
Опухоль (новообразование) - патологическое разрастание тканей, состоящих из качественно изменившихся клеток, ставших атипичными в отношении дифференцировки, характера роста и передающих эти свойства при последующем делении.
Наибольшее распространение получила полиэтиологическая теория. Вещества или факторы внешней или внутренней среды, способные вызвать опухоли получили название канцерогенов.
Они классифицируются на:
1. Экзоканцерогены
· химическик (рак у человека в 80%)
· физические
· биологические
2. Эндоканцерогены - представлены продуктами обмена триптофана, тирозина, гормонами при нарушении их баланса в организме.
89. Роль нарушения реактивности организма в возникновении и развитии опухолей (значение наследственных факторов, изменения со стороны нервной, эндокринной и иммунной систем).
Роль наследственности в возникновении опухолей.
У человека роль наследственности четко прослеживается при анализе таких опухолевых заболеваний как ретинобластома, нейробластома, рак кишечника в результате множественного полипоза, однако большинство исследователей склонны считать наследственность только фактором, определяющим повышение или, наоборот, понижение устойчивости организма к опухолевому росту.
Нервная система и канцерогенез. Относительная автономность является характерным признаком опухолевого роста, т.е. в его возникновении важная роль принадлежит нарушению функции нервной системы.
Увеличение раковых опухолей у людей, особенно в связи с невосполнимой утратой близкого человека, способствующей значительному и длительному состоянию депрессии. Отмечено нарастание частоты раковых опухолей у лиц с быстро развивающейся депрессией в результате стресса.
Роль нарушений эндокринной системы в возникновении опухолей
Важную роль, как в этиологии, так и патогенезе опухолей имеют гормоны. Гормоны обладают канцерогенным и антиканцерогенным действием. Канцерогенный эффект вызывают гормоны, стимулирующие пролиферацию — гонадотропные и половые. Тироксин, инсулин, небольшие дозы кортикостероидов тормозят образование и развитие опухолей.
Кейлоны, являясь высокомолекулярными полипептидами или низкомолекулярными белками, рассматриваются как тканевые гормоны, постоянно продуцируемые клеткой и оказывающие антимитотический эффект. Кейлоны стимулируют образование цАМФ, который и ингибирует деление клеток
Роль нарушений иммунитета в возникновении опухолей
Состояние иммунологической реактивности определяет как противоопухолевую устойчивость, так и формирование опухолевого процесса в организме. Иммунодепрессивное действие установлено для химических и физических канцерогенов.
90. Инициальные (клеточные) механизмы канцерогенеза.
Канцерогене́з — сложный патофизиологический процесс зарождения и развития опухоли.
Опухоль (новообразование) - патологическое разрастание тканей, состоящих из качественно изменившихся клеток, ставших атипичными в отношении дифференцировки, характера роста и передающих эти свойства при последующем делении.
Возникновение опухоли - это многостадийный процесс, включающий 3 этапа (стадии):
I этап - инициация (трансформация) — приобретение исходной нормальной клеткой способности беспредельно размножаться. Превращение нормальной клетки в опухолевую (трансформация, или инициация) является результатом стойких изменений в геноме клетки - мутации одного из генов, регулирующих клеточное размножение. Вследствие этого клетка становится инициированной (потенциально способной к неограниченному размножению), но требующей для проявления этой способности ряда дополнительных условий. Инициирующими факторами служат различные канцерогены, вызывающие повреждения ДНК.
II этап — промоция, или активизация опухолевых клеток.
III этап - опухолевая прогрессия, или стойкие качественные изменения свойств опухоли в сторону малигнизации (приобретение клетками нормальной или патологически изменённой ткани организма), возникающие по мере ее роста.
91. Биологические особенности опухолей.
Клетки злокачественной опухоли морфологически отличаются от нормальной клетки-предшественника, соседних опухолевых клеток и образуют искаженные тканевые структуры-низкодифференцированные, анапластические. Эти опухоли растут быстро, прорастают в соседние структуры, а отдельные опухолевые клетки формируют близко расположенные или отдаленные точки роста-метастазы.
Типы злокачественных опухолей:
-Карцинома- опухоли, происходящие из эпителия
-аденокарцинома-происходящие из эпителия, и имеющие железистый компонент
-саркомы-происходящие из тканей мезенхимного происхождения.

Они, как правило, хорошо поддаются хирургическому лечению и редко рецидивируют
Наиболее распространенные доброкачественные опухоли:
Миома матки — развивается из мышечной стенки матки: тело, шейка матки. Этот тип опухоли развивается у 15-17% женщин в возрасте старше 30 лет. Проявляется в основном маточными кровотечениями, увеличением размеров матки, болями в нижней части живота
Аденома — развивается из железистого эпителия различных желез организма (щитовидной, предстательной, слюнных желез). Чаще всего имеет грибообразную форму или форму узелка. Нередко сохраняет способность продуцировать характерный для данного органа секрет (слизь, коллоид). Может развиваться бессимптомно
92. Автономность роста опухолей и ее механизмы
Опухоль (новообразование) - патологическое разрастание тканей, состоящих из качественно изменившихся клеток, ставших атипичными в отношении дифференцировки, характера роста и передающих эти свойства при последующем делении.
Автономность характеризуется независимым от регулирующих влияний ростом опухоли. В результате автономности появившаяся злокачественная опухоль безудержно растет и приводит (без лечения) к смертельному исходу. Рост опухоли продолжается даже в условиях голодания. Автономность не является абсолютной. Разные опухоли обладают различной чувствительностью к регулирующим влияниям.
Между опухолью и организмом складываются сложные взаимоотношения. Из организма опухоль получает питательные вещества, сохраняются нервные, эндокринные, иммунологические влияния. В опухолевых клетках обнаружены сложные рецепторные системы, способные воспринимать регулирующие влияния. Во многом явления автономности можно объяснить нарушениями контактного ингибирования (подавления) опухолевых клеток, образования простагландинов, а также изменениями рецепторного аппарата и кальция для нервных и гуморальных влияний.
93. Инвазивность роста опухолей, ее механизмы. Метастазирование, пути, механизмы.
Инвазия и метастазирование - главные проявления прогрессии опухоли. Инвазивный рост - это активное проникновение опухолевых клеток через тканевые барьеры. Опухоль прорастает в окружающие ткани в результате дополнительных генетических и биохимических изменений. Инвазивный рост - результат изменения чувствительности клеток к активирующим и тормозным сигналам и нарушения равновесия между регулируемыми ими процессами.
Три неотъемлемых компонента инвазивного роста - это:
- адгезия опухолевых клеток к окружающим структурам ,
- миграция опухолевых клеток .
В зоне инвазивного роста все эти процессы идут постоянно:
- опухолевые клетки прикрепляются к компонентам базальной мембраны или подлежащей соединительной ткани;
- вырабатывая протеазы либо стимулируя выработку протеаз фибробластами, опухолевые клетки разрушают окружающие ткани;
- в результате образуется своего рода коридор, по которому опухолевые клетки проникают внутрь сосудов.
Метастази́рование — процесс образования вторичных очагов опухолевого роста (метастазов) в результате распространения клеток из первичного очага в другие ткани.
Механизмы
1. Интравазация — проникновение опухолевых клеток в просвет кровеносного или лимфатического сосуда;
2. Диссеминация — перенос опухолевых клеток током крови или лимфы;
3. Эмболия — остановка опухолевых клеток на новом месте;
4. Экстравазация — выход опухолевых клеток в периваскулярную ткань;
5. Рост метастаза.
Существует три основных пути метастазирования опухолей:
· лимфогенный (распространение раковых клеток по лимфатическим сосудам);
· гематогенный (распространение по кровеносным руслу);
· имплантационный (проникновение раковых клеток по серозным оболочкам после прорастания опухолями стенок пораженного органа).
94. Опухолевая прогрессия. Системное действие опухоли на организм (влияние на нервную, эндокринную систему).
Опухолевый рост - типовая форма нарушения тканевого роста, возникающая под действием канцерогена. Характерезуется атипизмом роста, обмена веществ, структуры и функции.
Опухолевый рост проявляется патологическим разрастанием ткани с атипичными свойствами.
Нарушение нервной системы.
Происходят дегенеративные изменения нервных окончаний в опухолях и нарушается функциональное состояние различных отделов нервной системы. При росте опухоли снижается биоэлектрическая активность нервных проводников. У больных признаки безразличия, потери интереса к окружающему миру и, наоборот, явления психоза на поздних стадиях опухолевого роста.
Нарушения эндокринной системы.
Проявляются изменениями различных звеньев гуморального регуляторного механизма, но особенно страдает звено синтеза и секреции, транспорта и эффекта (нарушения рецепции опухолевых клеток к гормональным влияниям).
Сначала наблюдается повышение интенсивности обмена катехоламинов с последующей их нормализацией. На третьем месяце с начала образования опухолевых очагов снова активируется симпато-адреналовая система. На поздних стадиях опухолевого роста снижается функция симпато-адреналовой системы.
Происходит увеличение гистамина в тканях, обеднение их катехоламинами, изменение соотношения адреналина и норадреналина, снижение сродства рецепторов клеток к серотонину.
содержание .. 14 15 16 17 ..