содержание .. 1 2 3 ..
ВСЕРОССИЙСКАЯ ОЛИМПИАДА ШКОЛЬНИКОВ ПО ХИМИИ - часть 2
Задача 2
Условие задачи
При пропускании паров воды через оксид кальция масса реакционной смеси
увеличилась на 9,65%. Определите процентный состав полученной твердой смеси.
Решение
Запишем уравнения химической реакции:
СаO + H2O = Са(OH)2
Конечная смесь является твердым веществом и может состоять только из гидроксида
кальция или смеси оксида с гидроксидом кальция, поэтому можно сделать вывод, что вода
прореагировала полностью и прирост массы реакционной смеси равен массе
прореагировавшей воды.
Проведем расчеты:
пусть исходное количество оксида кальция равна х моль, тогда:
масса прореагировавшей воды: m(H2O) = M(CaO)·ν(CaOисх)·ω = (40+16)·х·0,0965= 5,4 х,
количество моль прореагировавшей воды: ν(H2O) = 5,4 х/18 = 0,3 х
т.к. по уравнению реакции CaO и H2O реагируют в соотношении
1:1, количество
реагирующих веществ равны: ν(СаOреаг) = ν(H2O) = ν(Са(OH)2) = 0,3 х
Зная количества веществ можно определить массы оставшегося CaO и
образовавшегося Ca(OH)2:
m(СаOост.) = 0,7·х·(40+16) = 39,2х,
m(Са(OH)2) = (40+32+2) ·0,3х = 22,2х,
при этом общая масса конечной смеси m(смеси) = 61,4х
ω(СаO) = 100%·39,2х/ 61,4х = 63,84%
ω(Са(OH)2) = 100%·22,2х/61,4х = 36,16%
Те же результаты можно получить, предположив, что исходная смесь содержит 1 моль
оксида кальция, т.е. х = 1.
Ответ: ω(СаO) = 63,84% ω(Са(OH)) = 36,16%
Система оценивания:
1
Уравнение химической реакции
2 балла
2
Обоснованный вывод о том, что вода прореагировала полностью
1 балл
3
Обоснованный вывод о том, что представляет собой полученная смесь
2 балла
4
Расчет массы СаО в полученной смеси
2 балла
5
Расчет массы Са(ОН)2 в полученной смеси
1 балл
6
Расчет массы полученной смеси
1 балл
7
Расчет w(СаO)
1 балл
8
Расчет w(Са(OH)2)
1 балл
ИТОГО:
10 баллов
11
Задача 3
Условие задачи
Известь является одним из наиболее распространенных и разносторонне
используемых химических продуктов, производимых и потребляемых по всему миру.
Общемировое производство негашеной извести (оксид кальция), оценивается в 300 млн. тонн
в год. Получают ее обжигом известняка (карбонат кальция) при температуре 1100-1200 оС.
При взаимодействии негашеной извести с водой происходит процесс
«гашенияª и
получается гашеная известь (гидроксид кальция).
1. Напишите уравнения реакций, приводящих к получению гашеной извести из
известняка. Приведите по 1 примеру использования извести дома (в квартире) и в саду
(огороде, на даче).
2. Оцените массу известняка, расходуемую ежегодно на производство извести и массу
гашеной извести, которую можно было получать каждый год, погасив всю известь.
Насыщенный водный раствор гашеной извести называется «известковая водаª и
используется как качественный реактив на углекислый газ. В
100 г такого раствора
содержится всего 0,16 г самой гашеной извести. Плотность этого раствора практически не
отличается от плотности чистой воды (
= 1 г/мл).
Н2О
3. Какие видимые изменения происходят с известковой водой при пропускании через
нее углекислого газа? Напишите уравнение реакции.
4. Рассчитайте для 300 г известковой воды:
а) Количество ионов кальция (в штуках);
б) Концентрацию гидроксид-ионов в моль/л;
в) Массу углекислого газа, которую этот раствор может поглотить с образованием
максимального количества осадка;
г) Минимальный объем углекислого газа (н.у.), который следует пропустить через
этот раствор, чтобы выпадающий вначале осадок полностью растворился. Напишите
уравнение реакции.
5. Из перечисленного списка веществ: хлорид натрия, хлорид меди, хлороводород,
оксид серы(IV), оксид натрия, оксид меди(II):
а) Выберите и укажите вещества, с которыми известковая вода не реагирует;
б) Выберите и укажите вещества, с которыми известковая вода реагирует, и напишите
уравнения реакций.
12
Решение
1. Уравнения реакций: СаСО3 = СаО + СО2 ; СаО + H2O = Са(OH)2.
Дома известь используют при ремонте
(побелка, добавление в штукатурные,
шпатлевочные и др. вяжущие смеси), в саду для борьбы с вредителями и для
предотвращения солнечных ожогов белят стволы деревьев и кустарников, а также
известкуют кислые почвы.
2. По уравнениям реакций из 1 моля (40+12+3*16 = 100 г) известняка получается 1
моль (40+16 = 56 г) негашеной, а затем 1 моль (40+2*(16+1) = 74 г) гашеной извести.
Соответственно, для получения
300 млн. т. негашеной извести требуется
300*100/56
=
536 млн. т. известняка. Масса гашеной извести, которую можно получать каждый год,
погасив всю известь, составляет 300*74/56 = 396 млн. т.
3. При пропускании углекислого газа через прозрачную известковую воду
наблюдается ее помутнение.
Уравнение реакции: Са(ОН)2 + СО2 = СаСО3
+ Н2О.
4. В 300 г известковой воды содержится 0,16*300/100 = 0,48 г Ca(OH)2, что составляет
0,48/(40+2*17) = 6,49*10-3 моля. Отвечаем по пунктам:
а) Количество ионов кальция будет равно 6,49*10-3*6,02*1023 = 3,91*1021 штук;
б) Молярная концентрация гидроксид-ионов 2*6,49*10-3/0,3 = 0,0433 моль/л;
в) Осадок, образующийся в реакции с углекислым газом, - карбонат кальция:
Уравнение реакции: Са(ОН)2 + СО2 = СаСО3
+ Н2О.
Его максимальное количество равно количеству Ca(OH)2, для чего в молях
необходимо столько же CO2, масса которого составит 6,49*10-3*44 = 0,286 г;
г) При избытке углекислого газа осадок растворяется.
Уравнение реакции: СаСО3
+ Н2О + СО2 = Са(НСО3)2.
Чтобы он растворился весь, требуется как минимум еще столько же СО2 (6,49*10-3
моля), т.е. всего 2*6,49*10-3 = 12,98*10-3 моля.
Минимальный объем углекислого газа при н.у. составит 12,98*10-3*22,4 = 0,291 л.
5. а) Не реагирует известковая вода только с хлоридом натрия и оксидом меди;
б) С остальными 4 веществами известковая вода реагирует, причем оксид натрия
реагирует не с растворенной известью, а с водой.
Уравнения реакций:
Са(ОН)2 + CuCl2 = Сu(OH)2
+ CaCl2;
Са(ОН)2 + 2HCl = 2Н2О + СаCl2;
Са(ОН)2 + SО2 = СаSО3
+ Н2О;
Na2O + H2O = 2NаОН.
13
Система оценивания:
1 Два уравнения реакций по 1 б
2 балла;
Два примера использование извести по 1 б
2 балла;
2 Верные расчеты масс известняка и гашеной извести по 2 б
2+2 = 4 балла;
3 Помутнение 1 б, уравнение реакции 1 б
1+1 = 2 балла;
4 Верные расчеты а)-г) по 2 б, уравнение реакции г) 1 б
4*2+1=9баллов;
5 Верные указания «реагирует/не реагируетª по 0,5 б
6*0,5 = 3балла
Уравнения реакций по 1 б
4*1=4 балла.
ИТОГО 26 баллов
Задача 4 (экспериментальный тур)
На экспериментальных турах школьных химических олимпиад участникам можно
предложить выполнить задачу по распознаванию водных растворов различных веществ. Для
решения таких задач от участника требуется не только знание различных качественных
реакций, но и наблюдательность, логическое мышление, аккуратность и другие весьма
важные качества для химика-экспериментатора.
Для проведения такого тура необходимо
несколько пронумерованных пробирок с исследуемыми растворами,
пробирки с подписанными растрами веществ, с помощью которых проводится
определение,
свободная пробирка или несколько пробирок для проведения опытов,
стакан с дистиллированной водой для промывки пробирок и большой стакан для
слива,
желательно расположить все пробирки в штативе на пластиковом подносе.
Задание
Установите содержимое пронумерованных пробирок 1-8, используя вспомогательные
растворы нитрата серебра, серной кислоты, гидроксида натрия. Пронумерованные пробирки
содержат растворы сульфата меди(II), карбоната натрия, перманганата калия, сульфида
натрия, хлорида аммония, хлорида никеля, нитрата алюминия, хромата калия.
1. Напишите формулы предложенных для распознавания солей.
2. Исследуйте взаимодействие всех неокрашенных веществ с всеми вспомогательными
растворами. Для этого небольшое количество исследуемого раствора перелейте в чистую
пробирку, добавьте несколько капель вспомогательного раствора, перемешайте, запишите
наблюдения в таблицу:
14

Анализируемые
Пробирка№__
Пробирка №__
Пробирка №__
Пробирка №__
вещества
AgNO3
H2SO4
NaOH
Вылейте содержимое пробирки в стакан для слива, промойте пробирку несколько раз
водой.
3. Напишите уравнения всех реакций, которые были использованы для распознавания
бесцветных растворов.
4. Руководствуясь окрасками растворов веществ, попробуйте соотнести номер пробирки с
формулами соответствующих солей. Испытайте действие щелочи и кислоты на растворы
окрашенных солей, заполните таблицу:
Анализируемые
Пробирка
Пробирка
Пробирка
Пробирка
вещества
№__
№__
№__
№__
H2SO4
NaOH
5. И напишите уравнения всех реакций, протекающих при взаимодействии растворов
кислоты и щелочи с исследуемыми растворами.
Решение
1. Сульфат меди(II) - CuSO4, карбонат натрия - Na2CO3, перманганат калия - KMnO4,
сульфид натрия - Na2S, хлорид аммония - NH4Cl, хлорид никеля - NiCl2, нитрат алюминия -
Al(NO3)3, хромата калия - K2CrO4.
2. Перечисленные растворы можно разделить на две группы: половина из них окрашена в
различные цвета, другие - бесцветны:
Окрашенные Неокрашенные
CuSO4
Na2CO3
KMnO4
Na2S
NiCl2
NH4Cl
K2CrO4
Al(NO3)3
Составим теоретическую таблицу, расположив по горизонтали вещества, которые нам нужно
определить, а по вертикали - дополнительные реагенты. На пересечении каждого столбца и
строки укажем явления, которые мы бы наблюдали при сливании этих растворов.
15

Анализируемые
Na2CO3
Na2S
NH4Cl
Al(NO3)3
вещества
белый
черный
белый осадок
нет видимых
творожистый
AgNO3
осадок
реакция 1а
изменений
осадок
реакция 2а
реакция 3а
"вскипание"
появление
раствора
запаха
нет видимых
нет видимых
H2SO4
(выделяется
"тухлых яиц"
изменений
изменений
газ без запаха)
реакция 2б
реакция 1б
белый осадок
реакция 4а,
появление запаха
нет видимых
нет видимых
который исчезает
NaOH
аммиака
изменений
изменений
при добавлении
реакция 3б
избытка NaOH
реакция 4б
Сопоставив полученную таблицу с результатами эксперимента, приходим к выводу,
что в пробирках с бесцветными растворами находятся следующие вещества:
В той пробирке, где выпал белый осадок при добавлении AgNO3, при добавлении
кислоты выделялся газ без цвета и запаха (наблюдалось «вскипаниеª), а при добавлении
щелочи видимых изменений не было, находился р-р Na2CO3 (это пробирка № __);
В той пробирке, где выпал черный осадок при добавлении AgNO3, при добавлении
кислоты был запах тухлых яиц, а при добавлении щелочи видимых изменений не было,
находился р-р Na2S (это пробирка № __);
В той пробирке, где выпал белый творожистый осадок при добавлении AgNO3, при
добавлении щелочи был запах аммиака, а при добавлении кислоты видимых изменений не
было, находился р-р NH4Cl (это пробирка № __);
В той пробирке, где выпал белый осадок при добавлении NaOH, который растворялся
в избытке щелочи, а при добавлении кислоты или нитрата серебра видимых изменений не
было, находился р-р Al(NO3)3. (это пробирка № __)1
Итак: в пробирке № __ находится р-р Na2CO3
в пробирке № __ находится р-р Na2S
в пробирке № __ находится р-р NH4Cl
в пробирке № __ находится р-р Al(NO3)3
3. Уравнения реакций:
1а) Na2CO3 + 2AgNO3 = Ag2CO3
+ 2NaNO3;
1б) Na2CO3 + H2SO4 = Na2SO4 + CO2
+ H2O;
1 Вместо «__ª школьник пишет №, пробирки, который написал лаборант
16

2а) Na2S + 2AgNO3 = Ag2S
+ 2NaNO3;
2б) Na2S + H2SO4 = H2S
+ Na2SO4;
3а) NH4Cl + AgNO3 = AgCl
+ NH4NO3;
3б) NH4Cl + NaOH = NH3
+ H2O + NaCl.
4а) Al(NO3)3 + 3NaOH = Al(OH)3
+ 3NaNO3;
4б) Al(OH)3 + NaOH = Na[Al(OH)4] или
Al(OH)3 + 3NaOH = Na3[Al(OH)6];
4. Ниже предлагается соответствие окрасок растворов и номеров пробирок в одном из
вариантов для распознавания.
№ пробирки
Окраска раствора
желтая
зеленая
голубая
от розовой до фиолетовой
Окраска водных растворов обусловлена присутствием в них следующих ионов:
голубая - Cu2+, зеленая - Ni2+, желтая - CrO42 , от розовой до фиолетовой - MnO4ˉ. Эти
знания позволяют установить содержимое пробирок с окрашенными растворами:
№ __ - р-р K2CrO4, № __ - р-р NiCl2, № __ - р-р CuSO4, № __ - р-р KMnO4.
Составим теоретическую таблицу, расположив по горизонтали вещества, которые нам
нужно определить, а по вертикали - дополнительные реагенты. На пересечении каждого
столбца и строки укажем явления, которые мы бы наблюдали при сливании этих растворов.
Анализируемые
CuSO4
NiCl2
K2CrO4
KMnO4
вещества
р-р изменил
нет видимых
нет видимых
нет видимых
H2SO4
окраску на
изменений
изменений
изменений
оранжевую
выпал осадок
выпал яблочно-
нет видимых
нет видимых
NaOH
синего цвета
зеленый осадок
изменений
изменений
Приведены наблюдения при сливании разбавленных растворов.
Если использовать концентрированный раствор NaOH, то в избытке этого раствора
растворится синий осадок гидроксида меди:
Cu(OH)2 + 2 NaOH(конц) = Na2[Cu(OH)4]
Кроме этого возможно изменение окраски раствора перманганата калия в щелочной
среде из-за разложения:
4MnO4ˉ + 4OHˉ = 4MnO42ˉ + 2H2O+O2
Раствор приобретет сначала темную, почти черную окраску из-за смешения зеленого
и фиолетового, а потом станет зеленым.
5. Уравнения реакций:
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
17
CuSO4+ 2 NaOH = Cu(OH)2
+ Na2SO4
NiCl2+ 2 NaOH = Ni(OH)2
+ 2NaCl
Система оценивания:
1 Формулы солей по 0,5 б
0,5*8 = 4 балла;
2 Соотнесение солей по признакам реакций по 0,5 б
0,5*4 = 2 балла;
Заполнение таблицы с наблюдениями по 0,5 баллов
0,5*12 = 6 баллов;
3 Уравнения реакций по 1 б
1*8 = 8 баллов;
4 Соотнесение солей по цвету по 0,5 б
0,5*4 = 2 балла;
Заполнение таблицы с наблюдениями по 0,5 баллов
0.5*8 = 4 балла
5 Уравнения реакций по 1 б
1*3 = 3 балла.
ИТОГО 29 баллов
18
Образцы (примеры) заданий
Теоретический тур
Неорганическая химия
Варьирование соотношения количеств реагирующих веществ, приводящее к разным
результатам.
Н1. К трем порциям 0,1 М H2SO4 объемом 20 мл каждая прилили а) 10 мл 0.2 М
KOH, б) 80 мл 0,025 М NaOH, в) 30 мл 0,25 М KOH.
Рассчитайте молярные концентрации продуктов реакции в каждом из трех случаев.
Укажите рН среды полученных растворов (больше, меньше или около 7).
В ходе решения этой задачи в случае а) получается средняя соль K2SO4 (рН раствора
нейтральный), в случае б) получается кислая соль KHSO4 (значение рН раствора меньше 7), в
случае в) получается, что щелочь остается в избытке (значение рН раствора больше 7).
Количества исходных веществ можно задавать по-разному - задавая массовую долю веществ
в сливаемых растворах или указывая массы веществ в растворах. Если вместо серной
кислоты взять слабую многоосновную кислоту, например, фосфорную, то в зависимости от
соотношения исходных веществ вариантов получается гораздо больше: продуктами могут
быть кислая соль (дигидрофосфат или гидрофосфат), средняя соль (фосфат), буферный
раствор (гидрофосфат/дигидрофосфат) или раствор фосфата и оставшейся щелочи. Вариант
разработки этой идеи - пропускание через воду в разном соотношении хлороводорода и
аммиака.
Н2. Задание на умение использовать Периодический закон Д.И.Менделеева для
предсказания тех или иных свойств веществ различных элементов.
Определите возможные элементы (X, Y, Z), соединения которых участвуют в схемах
превращений:
XO3 + H2O → H2XO4
Y2O3 + HCl → YCl3 + H2O
Z2O7 + NaOH → NaZO4 + H2O
если буквами X, Y, Z зашифрованы p-элементы
Запишите уравнения соответствующих реакций.
Н3. Дана цепочка превращений:
X → XO2 → XO3 → H2XO4 → K2XO4
↓
↑
K2XO3
─────KMnO4/H+─────┘
Определите элемент X. Напишите уравнения соответствующих реакций.
Н4. Можно построить задачу на
«выпадающихª из общих закономерностей
свойств соединений, например, литий. Причем, необязательно учащийся может об этих
19
свойствах знать, вывод о них он сделает в ходе решения задачи.
Навеску металла массой 0,5 г осторожно растворили в 50 мл воды. В полученный
раствор пропустили избыток газа с плотностью по неону 2,2. Продукт выпарили и
прокалили до постоянной массы в инертной атмосфере. Масса продукта составила 1,07 г.
Н5. При растворении 51,1 г неизвестного металла в 500 мл 10% соляной кислоты
(плотность 1,01 г/мл) выделилось 2,8 л водорода (н.у.). Запишите формулу высшего оксида
этого металла.
Н6. В задачах на строение вещества можно использовать знание геометрии для
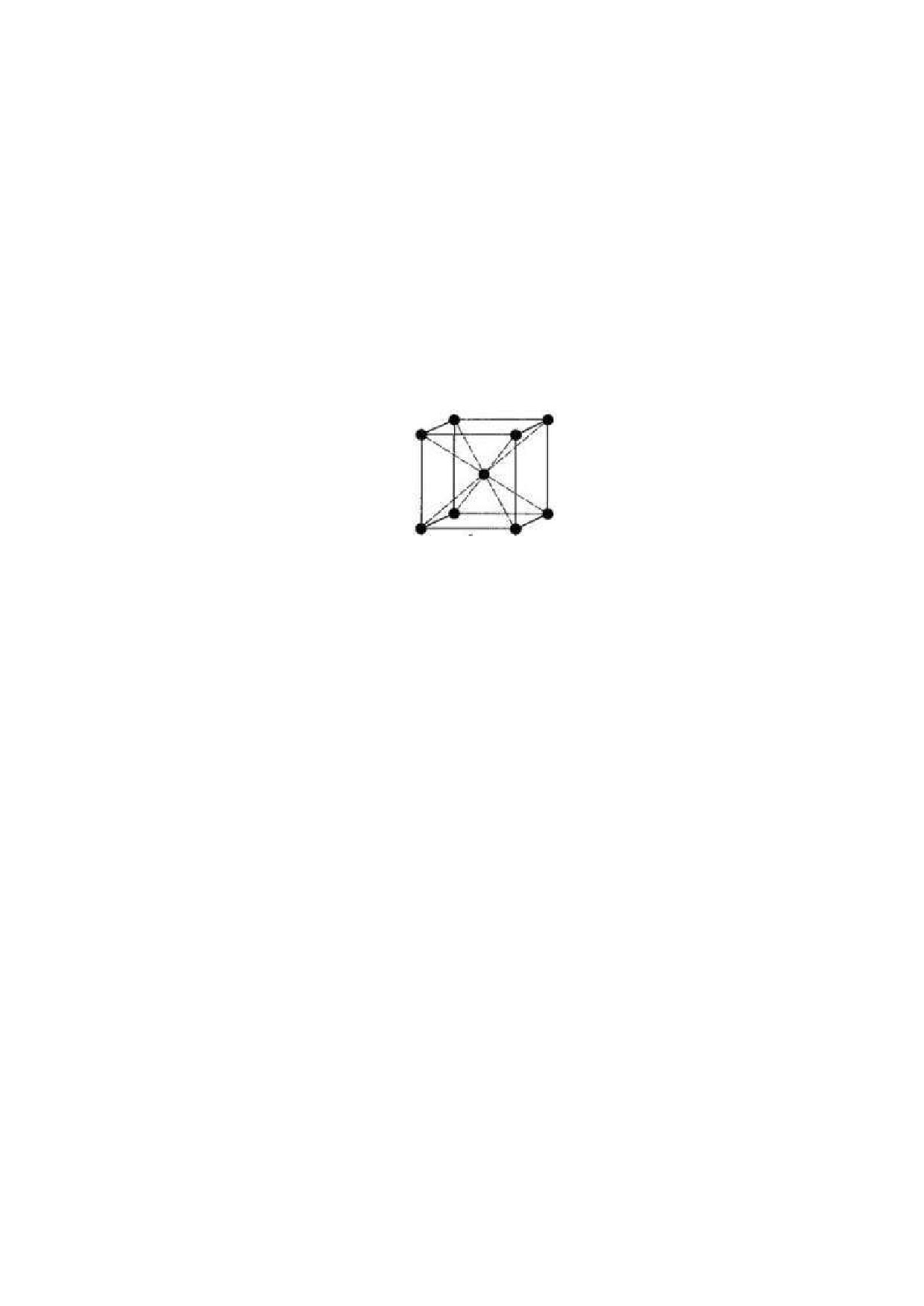
расчета числа атомов в элементарных ячейках кристаллических решеток.
Кристаллическая решетка лития является кубической объемноцентрированная.
Рассчитайте, сколько атомов лития приходится на одну элементарную ячейку.
В задаче можно запросить рассчитать радиус атома лития, длину ребра элементарной ячейки,
плотность лития, металлический радиус.
Н7. можно использовать “отвлекающие” данные, например, цвета раствора.
Оксид металла с массовой долей металла 80% растворяется в 20% серной кислоте с
образованием раствора голубого цвета и в 24% соляной кислоте с образованием раствора
зеленого цвета. Установите состав оксида, выведите формулу продукта взаимодействия
оксида с соляной кислотой, если известно, что в нем содержится 30,8% металла и 68,3%
хлора по массе. Напишите уравнения соответствующих реакций.
Зеленая окраска соединения меди (II) может сбить с толку решающего. В первый момент это
приводит к удивлению и заставляет критически подойти к собственному решению. В
предлагаемом варианте задания дается состав комплексного соединения меди
(II), что
придает обучающий характер задаче.
Задачи могут также быть составлены на основе химии других переходных металлов, для
которых характерно изменение цвета при изменении степени окисления и координационного
окружения.
Н8 Использование знаний о специфических свойствах однотипных соединений,
например, различное отношение амфотерных гидроксидов к взаимодействию с раствором
аммиака.
Металл(Х) растворяется в соляной кислоте. При взаимодействии хлорида этого металла с
избытком щелочи образуется прозрачный раствор, а при добавлении к раствору этого же
20

хлорида избытка аммиака выпадает гелеобразный осадок. Определите неизвестный металл
и запишите уравнения упомянутых в задаче реакций.
Н9 Задача может предполагать несколько вариантов ответа, например, разные
вещества могут иметь одну и ту же молярную массу:
В неорганической кислоте массовая доля кислорода равна 65,3%. Изобразите структурные
формулы кислот, отвечающих указанному условию.
В ходе решения задачи решающий выходит на молярную массу 98 г/моль. Такая молярная
масса у серной и у ортофосфорной кислот. Так же можно «зашифроватьª сероводород и
пероксид водорода, в которых массовая для водорода составляет 5,88%.
Н10 Другой вариант развития идеи - по относительной плотности газа по воздуху
(водороду или другому любому газу) определить молярную массу газа и предложить
несколько формул веществ.
Запишите химические формулы нескольких газов, плотность которых по воздуху
составляет 0,966. Опишите их окислительно-восстановительные свойства.
Молярную массу 28 г/моль имеют СО и С2Н4.
Органическая химия
О1. В заданиях с вопросом «изобразить все возможные изомерыª можно дать
вещества, которые имеют оптические изомеры.
Изобразите все изомеры соединения состава С4H9Cl.
Всего должно быть 5 изомеров.
О2. Использование в заданиях би- и полифункциональных органических
соединений. При этом требуются знания основных свойств классов органических веществ.
Напишите уравнения реакций:
K2C2O4
H2C2O4
C4H6O4
В данном примере используются знания, что карбоновые кислоты слабее, чем
минеральные и что карбоновые кислоты могут образовывать сложные эфиры, которые
вступают в реакцию щелочного гидролиза.
О3. При сжигании 2,25 г органическое вещество Х широко распространенного в
природе , образовалось 2,64 г диоксида углерода, 0,42 г азота и 1,35 г воды. Известно, что Х
реагирует с соляной кислотой и с гидроксидом натрия, образуя соли. Напишите
структурную формулу Х, напишите уравнения реакций. Приведите изомер вещества X.
По данным сгорания можно выйти на формулу глицина. Изомером ему является
21
содержание .. 1 2 3 ..