Семинар О порядке подготовки и оформления документов для государственной регистрации медицинских изделий
СЕМИНАР
О порядке
подготовки и оформления документов
для государственной регистрации
медицинских изделий
2
Основные нарушения и недостатки
при рассмотрении комплектов
регистрационной документации на
медицинские изделия, поступающих на
регистрацию
3
Государственная регистрация медицинского изделия
Основной нормативный документ:
Правила государственной регистрации медицинских изделий,
утвержденные постановлением Правительства Российской Федерации
от 27 декабря 2012 г. № 1416 (далее - Правила).
Для государственной регистрации медицинского изделия разработчик,
производитель медицинского изделия или уполномоченный представитель
производителя
(далее
- заявитель) представляет либо направляет в
регистрирующий орган заявление о государственной регистрации
медицинского изделия, а также документы, указанные в п. 10 Правил.
4
Оформление заявления
о государственной регистрации медицинского изделия
Требования к заявлению определены п.9 Правил.
¾ Заявление оформляется на бланке компании.
¾ Форма заявления установлена приказом Минздрава России от
14.10.2013
№737н «Об утверждении Административного регламента
Федеральной службы по надзору в сфере здравоохранения по
предоставлению государственной услуги по государственной
регистрации медицинских изделийª
¾ Все сведения, указанные в заявлении, должны соответствовать
документам, которые подаются вместе с заявлением о регистрации,
подтверждающим указанные сведения.
¾ При необходимости, заявление может иметь приложения.
5
Оформление заявления:
наименование медицинского изделия
При формировании наименования медицинского изделия рекомендуется
¾ Начинать с имени существительного:
устройство, аппарат, набор и т.п.
¾ Указывать признак того, что изделие предназначено для применения в
медицинских целях:
«инструменты хирургические..»,
«вата медицинская..»,
«микроскоп операционный..»
¾ Однозначно идентифицировать изделие:
указывать модель, вид, артикул, производственный номер, шифр КД.
¾ Указывать на русском языке,
при необходимости, в скобках - на иностранном языке (транслитерации).
¾ В случае наличия указывать торговую марку (или торговый знак),
к документом прикладывается
копия регистрации (Роспатент)
¾ Указывать номера ГОСТов или технических условий
6
Оформление заявления:
наиболее частые замечания
по указанию наименования медицинского изделия
¾ Отсутствие признака, позволяющего отнести продукцию к
медицинскому изделию:
- Инструменты режущие«
- Светильник бестеневой «Слава»
¾ Отсутствие документа, подтверждающего регистрацию торговой марки
или торгового знака.
7
Оформление заявления:
модели и варианты исполнения медицинского изделия
В наименовании возможно указание моделей и вариантов исполнения,
если они отвечают условиям (по применимости):
¾ имеют эквивалентное назначение, установленное производителем;
¾ имеют один и тот же класс риска;
¾ изготовлены на одной и той же конструктивной и технологической основе;
¾ иметь один и тот же принцип действия (применяется для неактивных
медицинских изделий);
¾ головная модель ряда содержит в себе весь набор функциональных
свойств и/или характеристик изделий ряда (применяется для активных
медицинских изделий).
8

Оформление заявления:
модели и варианты исполнения медицинского изделия
Примеры:
Анализатор крови медицинский портативный биохимический Element,
варианты исполнения Element, Element Multi.
Авторефрактометр: модели KR-9000; KR-9200; RM-9000; RM-9200.
Корсеты ортопедические по ТУ 9396-005-50910339-2006 в следующих
исполнениях: пояс корсетный ПК; корсет пояснично-крестцовый КПК;
корсет грудо-пояснично-крестцовый КГК; корректор осанки КО.
Аппараты ультразвуковые хирургические АУЗХ-100-"ФОТЕК" по ТУ
9444-014-41747567-2009, варианты исполнения АУЗХ-100-01-
«ФОТЕКª, АУЗХ-100-02-«ФОТЕКª.
9

Оформление заявления:
состав и принадлежности медицинского изделия
Принадлежности - это предметы, самостоятельно не являющиеся
медицинскими изделиями и по целевому назначению применяемые совместно с
медицинским изделием либо в его составе для того, чтобы медицинское изделие
могло быть использовано в соответствии с целевым назначением.
ГОСТ Р 31508-2012
Состав медицинского изделия (или принадлежности) необходимо указывать в
виде нумерованного/маркированного списка.
Если изделия могут применяться в медицинских целях самостоятельно
(отдельно от Медицинского изделия), включая одноразовую продукцию и
расходные материалы, то рекомендуется их:
- включать состав Медицинского изделия и указывать в заявлении;
ИЛИ
- исключать из заявления и регистрировать отдельно.
10

Оформление заявления:
состав и принадлежности медицинского изделия
Состав медицинского изделия
Если
комплектующие
и/или
принадлежности приведены во
множественном
числе,
то
необходимо указать
конкретное количество, которое
может поставляться с одним
медицинским изделием, либо
использовать фразу «не болееª.

Оформление заявления:
состав и принадлежности медицинского изделия
12
Оформление заявления:
наиболее частые замечания по указанию наименования
До 50 % всех замечаний:
¾ Состав, указанный в заявлении, не соответствует составу,
указанному в технической и эксплуатационной документации.
¾ Отсутствует указание, являются ли предметы, перечисленные в
заявлении, принадлежностями или входят в состав медицинского
изделия.
¾ В качестве принадлежностей указаны самостоятельные изделия.
13
Оформление заявления:
наиболее частые замечания по указанию юридического лица
¾ Не указаны полная или сокращенная форма юридического лица.
¾ Не указан ИНН.
¾ Прилагаемые к заявлению документы не подтверждают, что лицо,
указанное разработчиком, является таковым.
14
Оформление заявления:
производитель медицинского изделия
ПРОИЗВОДИТЕЛЬ указываются сведения о компании-производителе.
¾ Сведения должны соответствовать сведениям в технической
документации.
¾ Наименование зарубежного производителя необходимо указывать в
англоязычной и русскоязычной транслитерациях.
¾ Адрес производителя - на английском языке.
15
Оформление заявления:
уполномоченный представитель производителя
представитель производителя
- юридическое
лицо, зарегистрированное на территории Российской Федерации,
уполномоченное производителем медицинского изделия представлять его
интересы по вопросам обращения медицинского изделия на территории
Российской Федерации, в том числе по вопросам процедур оценки
соответствия и государственной регистрации, на имя которого может быть
выдано регистрационное удостоверение на медицинское изделие
(Правила).
Наличие уполномоченного представителя производителя для
зарубежных производителей обязательно!
Его полномочия подтверждаются доверенностью производителя.
16

Оформление заявления:
уполномоченный представитель производителя изделия
полномочий:
¾ в форме доверенности
¾ в форме договора
1) с использованием формулировки:
«уполномоченный
представитель
производителя,
представляющий его интересы по вопросам обращения
медицинского изделия на территории Российской Федерации, в
том числе по вопросам процедур оценки соответствия и
государственной регистрацииª;
2) с подробным перечислением всех вопросов, входящих в понятие
«обращение медицинских изделийª
в Федеральном законе от 21.11.2011 №323-ФЗ.
17
Оформление заявления:
выдать регистрационное удостоверение на юридическое лицо
удостоверение может быть выдано на имя любого
юридического лица.
Для оформления регистрационного
на уполномоченного
представителя производителя, необходимо представить документы,
подтверждающие полномочия уполномоченного представителя
производителя.
Право быть «держателемª регистрационного удостоверения должно
быть подтверждено в доверенности производителя.
18
Оформление заявления:
адрес места производства медицинского изделия
Возможно указание нескольких мест производства.
Сведения о месте производства подтверждаются:
¾ для отечественных производителей - например, свидетельством о
праве собственности, договором аренды, лицензией на деятельность
по производству и техническому обслуживанию медицинской техники
или сертификатом ISO;
¾ для зарубежных производителей - документами, оформленными в
стране происхождения и заверенными в установленном порядке
(например, сертификатом ISO и СЕ).
Кроме того, представляется документ о производственных отношениях
между производителем и местом производства.
19

Оформление заявления:
назначение медицинского изделия
Назначение медицинского изделия, указанное в заявлении о
регистрации, должно совпадать с назначением, указанным в
технической и эксплуатационной документации
(например, в
технических условиях и руководстве по эксплуатации).
20

Оформление заявления:
вид медицинского изделия
Классификацию необходимо осуществлять в соответствии с Приказом
Минздрава России
06.06.2012
№
4н
«Об утверждении
номенклатурной классификации медицинских изделийª.
В одном регистрационном удостоверении не могут быть
объединены медицинские изделия, относящиеся к разным видам
хотя бы по одному классификационному признаку
(например,
стерильные и нестерильные; активные и неактивные медицинские
изделия; одноразового и многократного применения).
21

Оформление заявления:
замечания по классификации медицинского изделия
¾ Регистрация стерильных и нестерильных медицинских изделий:
Перчатки нитрилов
рильные опудренные и
перчатки латексн
льные неопудренные
¾ Регистрация медицинских изделий одноразового и многократного
применения:
Тест контроля эф
рилизационной очистки
медицинских инс
й и тест контроля
предстерилизацио
инских инструментов
многоразовый.
¾ Регистрация активных и неактивных медицинских изделий:
Кресло-коляска ме
яска электрическая.
22

Оформление заявления:
класс потенциального риска применения медицинского изделия
Классификацию необходимо осуществлять в соответствии с Приказом
Минздрава России
06.06.2012
№
4н
«Об утверждении
номенклатурной классификации медицинских изделийª.
¾ Если при классификации можно применить различные положения, то
применяются положения, вследствие которых устанавливается класс
потенциального риска наибольшей степени.
В одном регистрационном удостоверении не могут быть
объединены медицинские изделия, относящиеся к разным
классам потенциального риска применения.
23
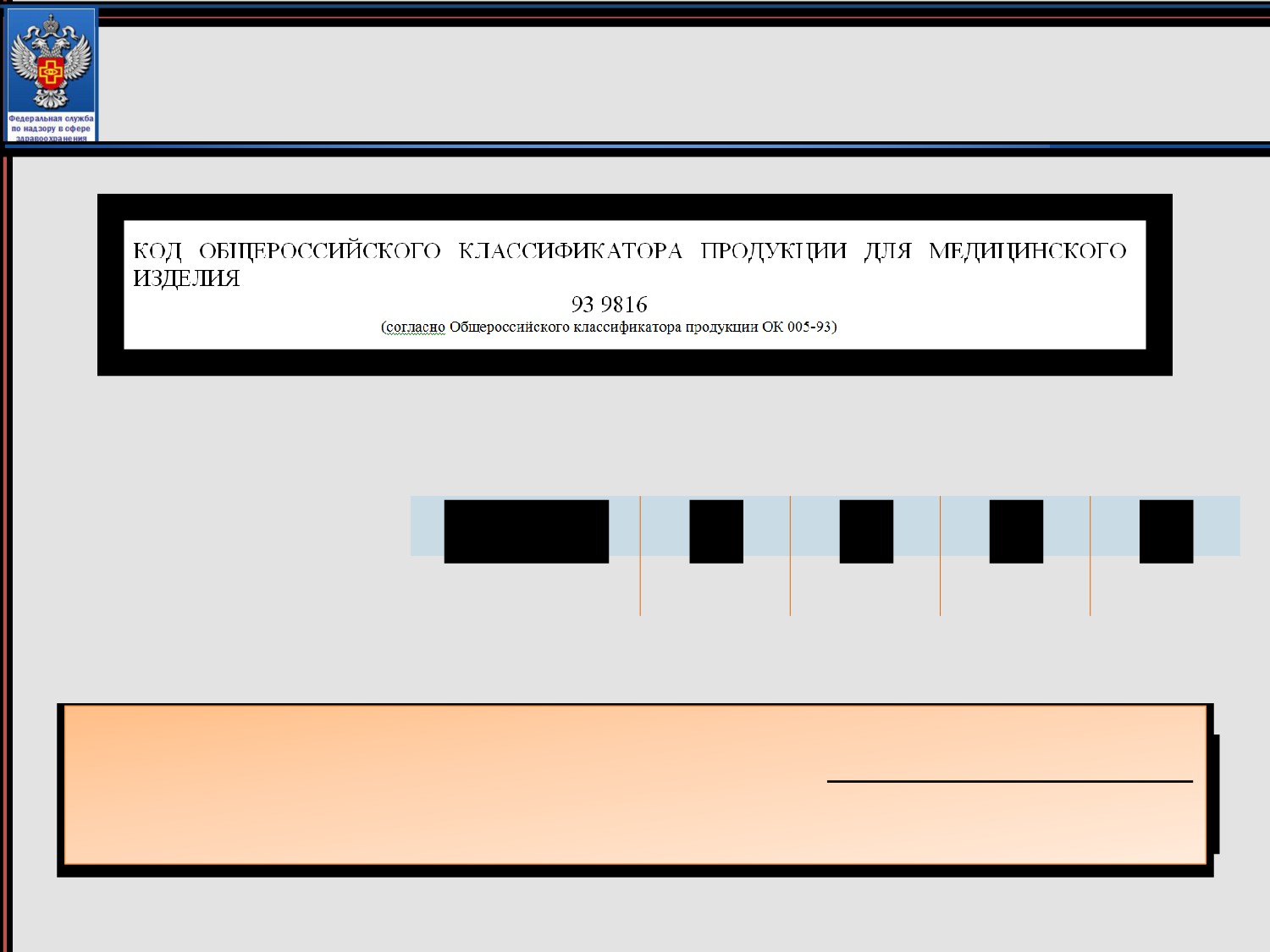
Оформление заявления:
код ОКП медицинского изделия
Классификацию необходимо осуществлять в соответствии с
Общероссийским классификатором продукции ОК 005-93.
9
3
9
8
1
6
Класс
подкласс
группа
подгруппа
вид
В одном регистрационном удостоверении не могут быть объединены
медицинские изделия, относящиеся к разным подклассам кода ОКП.
24
Оформление заявления:
способ получения информации
получения регистрационного удостоверения на
медицинское изделие:
¾ на бумажном носителе лично;
¾ на бумажном носителе направить заказным почтовым
отправлением с уведомлением о вручении;
¾ вформеэлектронногодокумента.
25

Документы регистрационного досье на медицинское изделие
Комплект документов, предоставляемых на регистрацию, представлен в п.10 Правил:
а) копия документа, подтверждающая полномочия уполномоченного представителя
производителя:
представляется доверенность от производителя, подтверждающая полномочия российского
юридического лица по вопросам обращения медицинского изделия в соответствии со ст.
38
Федерального закона от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской
Федерацииª;
б) сведения о нормативной документации:
сведения о нормативных и правовых актах (Федеральных законах, постановлениях Правительства
Российской Федерации, технических регламентах, нормативных документах Таможенного союза,
относящихся к заявляемому медицинскому изделию, перечне применяемых стандартов и т.п.)
применительно к медицинскому изделию.
в) техническая документация производителя (изготовителя) на медицинское изделие:
- документ, соответствующий требованиям пункта
4
Правил, заверенный производителем в
установленном порядке;
для российских производителей:
- технической документацией являются технические условия
- требуется представление акта квалификационных испытаний в составе технической документации, так
как этот документ подтверждает возможность производства
(наличие условий для производства)
заявленного к регистрации медицинского изделия по конкретному месту производства;
26
Документы регистрационного досье на медицинское изделие
г) эксплуатационная документация производителя (изготовителя) на медицинское изделие,
в том числе инструкция по применению или руководство по эксплуатации медицинского
изделия:
- документ, соответствующий требованиям пункта
4
Правил, заверенный производителем в
установленном порядке;
-
единственный документ, поступающий к потребителю, поэтому в эксплуатационной
документации производителя на медицинское изделие требуется представлять сведения об
уполномоченном представителе производителя.
д) фотографические изображения изделия общего вида медицинского изделия вместе с
принадлежностями, необходимыми для применения медицинского изделия по назначению
(размером не менее 18 х 24 сантиметра):
-
представляются четкие фотографические изображения, которые позволяют идентифицировать
медицинское изделие и его принадлежности.
е) документы, подтверждающие результаты технических испытаний медицинского изделия:
- представляются документы, соответствующие требованиям приказа Минздрава России от
09.01.2014 № 2н «Об утверждении Порядка проведения оценки соответствия медицинских изделий
в форме технических испытаний, токсикологических исследований, клинических испытаний в целях
государственной регистрации медицинских изделийª, оформленные испытательным центром или
лабораторией, аккредитованными Росаккредитацией.
Документы, подтверждающие результаты испытаний, заверяются организациями, в которых
испытания проводились.
27

Документы регистрационного досье на медицинское изделие
ж) документы, подтверждающие результаты токсикологических исследований медицинского
изделия, использование которого предполагает наличие контакта с организмом человека:
- представляются документы, соответствующие требованиям приказа Минздрава России от
09.01.2014 № 2н «Об утверждении Порядка проведения оценки соответствия медицинских изделий
в форме технических испытаний, токсикологических исследований, клинических испытаний в целях
государственной регистрации медицинских изделийª, оформленные испытательным центром или
лабораторией, аккредитованными Росаккредитацией.
Документы, подтверждающие результаты испытаний, заверяются организациями, в которых
испытания проводились.
з) документы, подтверждающие результаты испытаний медицинского изделия в целях
утверждения средства измерений
(в отношении медицинских изделий, относящихся к
средствам измерений в сфере государственного регулирования обеспечения единства
измерений, перечень которых утверждается Минздравом России):
- для изделий, входящих в перечень, утвержденный приказом Минздрава России от 15.08.2012
№89н «Об утверждении порядка проведения испытаний в целях утверждения типа средств
измерений, а также перечня медицинских изделий, относящихся к средствам измерений в сфере
государственного регулирования обеспечения единства измерений, в отношении которых
проводятся испытания в целях утверждения типа средств измеренийª;
- представляются документы, оформленные испытательным центром или лабораторией,
аккредитованными Росаккредитацией.
Документы, подтверждающие результаты испытаний, заверяются организациями, в которых
испытания проводились.
28
Документы регистрационного досье на медицинское изделие
и) опись документов:
- в соответствии с требованиями приказа Минздрава России от 14.10.2013 № 737н «Об утверждении
Административного регламента Федеральной службы по надзору в сфере здравоохранения по
предоставлению государственной услуги по государственной регистрации медицинских изделийª;
-
в случае повторного представления медицинского изделия для регистрации (после отказа), в
описи требуется указать документы, необходимые для приобщения из регистрационного досье
по которому получен отказ.
к) сведения, подтверждающие клиническую эффективность и безопасность медицинских
изделий (в случае, если имеется).
Для изделий 1 класса риска
¾ предоставляются в составе регистрационного досье
¾ разрешение на проведение клинических испытаний не требуется
л) проект плана клинических испытаний медицинского изделия с обосновывающими его
материалами (в случае, если имеется):
- представляется
(если имеется) для медицинских изделий классов потенциального риска
применения 2а, 2б, 3.
29
Стоимость государственной регистрации и экспертизы
качества, эффективности и безопасности медицинских изделий
Оплата взимается в соответствии с Федеральным законом от 21.07.2014 № 221-ФЗ «О
внесении изменений в главу
25.3
части второй Налогового кодекса Российской
Федерацииª, согласно которому сумма государственной пошлины за регистрацию
медицинских изделий составит 7 000 рублей, за экспертизу качества, эффективности
и безопасности медицинских изделий (в зависимости от класса потенциального риска
применения медицинского изделия):
¾ класс 1 - 45 000 рублей;
¾ класс 2а - 65 000 рублей;
¾ класс 2б - 85 000 рублей;
¾ класс 3 - 115 000 рублей.
Образцы платежных поручений на оплату государственной пошлины размещены на
официальном сайте Росздравнадзора www.roszdravnadzor.ru в разделе «Медицинские
изделияª → «Регистрация медицинских изделийª → «Формы документовª.
30
Спорные вопросы отнесения изделий к
медицинским. Критерии.

Определение медицинского изделия
(п.1 ст.38 Федерального закона от 21.11.2011 №323-ФЗ «Об
основах охраны здоровья граждан в Российской Федерации»)
Медицинскими изделиями являются любые инструменты,
аппараты, приборы, оборудование, материалы и прочие изделия,
применяемые в медицинских целях отдельно или в сочетании
между собой, а также вместе с другими принадлежностями,
необходимыми для применения указанных изделий по
назначению, включая специальное программное обеспечение, и
предназначенные
производителем
для
профилактики,
диагностики, лечения и медицинской реабилитации заболеваний,
мониторинга состояния организма человека, проведения
медицинских исследований, восстановления, замещения,
изменения анатомической структуры или физиологических
функций организма, предотвращения или прерывания
беременности, функциональное назначение которых не
реализуется путем фармакологического, иммунологического,
генетического или метаболического воздействия на организм
человека
33
Критерии отнесения к медицинским изделиям
Условия, вытекающие из определения медицинского изделия и основных
понятий, сформулированных в п. 4 Правил государственной регистрации
медицинских изделий, утвержденных постановлением Правительства
Российской Федерации от 27.12.2012 № 1416, которые необходимо учитывать
при анализе назначения медицинского изделия:
1.
2.
3.
Функциональное
Изделию должны
Свойства и
назначение изделия
быть объективно
характеристики
не реализуется путем
присущи свойства и
изделия должны
фармакологического,
характеристики,
найти свое отражение
иммунологического,
влияющие на его
в технических
генетического или
способность
характеристиках и
метаболического
действовать по
эксплуатационной
воздействия на
назначению в
документации
организм человека
медицинских целях
производителя
34

Формулирование назначения медицинского изделия
В заявлении на регистрацию медицинского изделия должно быть
указано наиболее полное и специфически сформулированное
назначение медицинского изделия.
Описание назначения медицинского изделия должно содержать
технические аспекты назначения, т.е. устройство и/или принцип
действия и/или само действие медицинского изделия,
обеспечивающее выполнение предназначенной медицинской
задачи, а также медицинские аспекты назначения.
Пример.
Компьютерный томограф «ХХХ»
предназначен для получения
изображений срезов человеческого
тела путем реконструкции сигнала
проходящего рентгеновского
излучения, регистрируемого под
разными углами в разных аксиальных
плоскостях, а также в режиме
спирального сканирования.

Номенклатурная классификация медицинских изделий
(Приказ Минздрава России от 16.06.2012 № 4н
«Об утверждении номенклатурной классификации медицинских изделий»)
Согласно п.2 ст. 38 Федерального закона от 21.11.2011 №323-ФЗ
«Об основах охраны здоровья граждан в Российской Федерации»:
Медицинские изделия подразделяются на виды в соответствии с
номенклатурной классификацией медицинских изделий
Номенклатурная классификация медицинских изделий по видам
не применяется для целей отнесения изделий к медицинским
(см. п.1 ст.38 Федерального закона от 21.11.2011 №323-ФЗ «Об
основах охраны здоровья граждан в Российской Федерацииª)
36

Разграничение:
медицинские изделия - лекарственные средства.
Примеры
№
Изделие
Классификация
1
Пластырь,
Лекарственное
средство,
если
назначение
содержащий
обеспечивается доставкой в
организм человека
лекарственное
лекарственного средства.
средство
Медицинское
изделие,
если
назначение
обеспечивается созданием защитного барьера, а
лекарственное средство лишь поддерживает
основное назначение
2
Суппозиторий
Лекарственное
средство,
если
назначение
вагинальный для
обеспечивается действием лекарственных средств,
поддержания и
входящих в состав изделия.
восстановления
Медицинское изделие, если назначение реализуется
баланса вагинальной
путем регулирования кислотности (рН)
микрофлоры
37
Разграничение:
медицинские изделия - не медицинские изделия.
Примеры
№
Изделие
Классификация
1
Тренажер
Медицинское изделие, если предназначен для
реабилитации/восстановления функций организма.
Не медицинское изделие, если предназначен
тренировки/поддержания физической формы
2
Обеззараживатель
Медицинское изделие, если предназначен для
воздуха
применения в медицинских целях
(например, в
операционных).
Не медицинское изделие, если предназначен для
бытового применения.
3
Программное
Медицинское
изделие,
если
специально
обеспечение
предназначено для медицинских целей (например,
(самостоятельное)
для диагностики).
38
Разграничение:
медицинские изделия для диагностики in vitro -
изделия для научных исследований
№
Изделие
Классификация
1
Набор реагентов для
Медицинское изделие для диагностики in vitro, если
определения маркера
получаемая информация
предназначена для
####### заболевания
применения к пациенту с
целью определения
физиологического или патологического состояния,
предрасположенности к определенному клиническому
состоянию или болезни, совместимости тканей с
потенциальным реципиентом,
прогнозирования
реакций на терапевтические воздействия, выбора
терапевтических средств и/или контроля лечения.
Не медицинское изделие для диагностики in vitro,
если получаемая информация предназначена для
научных целей (исследования связи определяемого
маркера
с
определенным
клиническим
состоянием/заболеванием) и не применяется к
пациенту с целью диагностики, определения
предрасположенности к определенному клиническому
состоянию или болезни, совместимости тканей или
контроля за лечением.
39
Основные вопросы, возникающие при
определении вида медицинского
изделия в соответствии с
номенклатурной классификацией

Нормативные правовые акты,
применяемые при определении вида медицинского изделия
Федеральный закон от 21.11.2011
№323-ФЗ «Об основах охраны
здоровья граждан в Российской Федерации» (п. 2 ст. 38)
Медицинские изделия должны подразделяться на виды в
соответствии с номенклатурной классификацией медицинских
изделий. Номенклатурная классификация медицинских изделий
утверждается
уполномоченным
федеральным
органом
исполнительной власти.
Постановление Правительства Российской Федерации от
27.12.2012
№ 1416 «Об утверждении правил государственной регистрации
медицинских изделий» (п. 9)
В заявлении о государственной регистрации медицинского изделия
указывается вид медицинского изделия в соответствии с
номенклатурной классификацией медицинских изделий.
42

Нормативные правовые акты,
применяемые при определении вида медицинского изделия
Приказ Минздрава России от 06.06.2012 № 4н
«Об утверждении номенклатурной классификации
медицинских изделий»
Приказ Минздрава России от 25.09.2014 № 557н
«О внесении изменения в приложение №1 к приказу
Министерства здравоохранения Российской Федерации
от 6 июня 2012 г. «Об утверждении номенклатурной
классификации медицинских изделий»
43

Номенклатурная классификация медицинских изделий по видам
Номенклатурная классификация медицинских изделий
- это
систематизированный номенклатурный классификатор видов медицинских
изделий, применяемый в целях идентификации медицинских изделий.
Сферы применения номенклатурной классификации медицинских
изделий:
¾ Мониторинг неблагоприятных событий, связанных с медицинскими
изделиями
¾ Решение внутриведомственных задач:
9
планирование
оснащения
лечебно-профилактических
учреждений;
9
привязка медицинских изделий к стандартам оказания
медицинской помощи

Номенклатурная классификация медицинских изделий по видам
Номенклатурная классификация медицинских изделий представляет собой
перечень видов медицинских изделий и построена как компьютерная
база данных, регулярно обновляемая, с доступом пользователей по сети
Интернет.
Вид или видовая группа - это совокупность медицинских изделий,
имеющих одинаковое или аналогичное назначение и общее устройство
(конструкцию).
Международный стандарт
ISO 15225-2010

Алгоритм формирования номенклатурной классификации
медицинских изделий по видам
XXXXXX
Числовое обозначение вида медицинского изделия -
шестизначный идентификационный уникальный номер
записи начиная с 100000. Для каждой последующей
записи значение увеличивается на 10
Наименование вида медицинского изделия
Описание вида медицинского изделия
Структура номенклатурной классификации
медицинских изделий по видам
Наименование вида не является стандартизованным наименованием
конкретного медицинского изделия, а определяет видовую группу
изделий.
Описание вида медицинского изделия содержит соответствующие
классификационные признаки вида медицинского изделия, указываемые
в зависимости от назначения медицинских изделий и(или) их устройства.
Классификационные признаки:
¾ область применения,
¾ инвазивность
¾ стерильность
¾ частота использования (однократного или многократного применения)
¾ эксплуатационные особенности
¾ конструктивные особенности

Формирование номенклатурной классификации
по группам и подгруппам
Номенклатурная классификация формируется по группам и подгруппам.
Они выполняют вспомогательную функцию, служат для навигации при поиске
видов.
Сформировано
19
групп. Каждая группа подразделяется на подгруппы.
Различные группы включают от 5-ти до 56-ти подгрупп. Один вид может
относиться к нескольким группам (подгруппам).
249380 «Зажим гемостатическийª
14. Сердечно-сосудистые
18. Хирургические
медицинские изделия
инструменты/системы и
14.14. Медицинские изделия
сопутствующие медицинские изделия
для сердечно-сосудистой
18.52. Щипцы и сопутствующие
хирургии
изделия

Группы номенклатурной классификации
медицинских изделий по видам
1.
Анестезиологические и респираторные медицинские изделия
2.
Вспомогательные и общебольничные медицинские изделия
3.
Гастроэнтерологические медицинские изделия
4.
Медицинские изделия для акушерства и гинекологии
5.
Медицинские изделия для диагностики in vitro
6.
Медицинские изделия для манипуляций/восстановления тканей/органов
человека
7.
Медицинские изделия для оториноларингологии
8.
Медицинские изделия для пластической хирургии и косметологии
9.
Неврологические медицинские изделия
10.
Офтальмологические медицинские изделия
11.
Радиологические медицинские изделия
12.
Реабилитационные и адаптированные для инвалидов медицинские изделия
13.
Сердечно-сосудистые медицинские изделия
14.
Стоматологические медицинские изделия
15.
Урологические медицинские изделия
16.
Физиотерапевтические медицинские изделия
17.
Хирургические инструменты/системы и сопутствующие медицинские изделия
18.
Эндоскопические медицинские изделия.
19.
Ортопедические медицинские изделия
Пример деления групп медицинских изделий на подгруппы
3. Гастроэнтерологические медицинские изделия
3.1
Анализаторы физиологических параметров гастроэнтерологические
3.2
Детоксиканты гастроэнтерологические
3.3
Иглы для пневмоперитонеума
3.4
Ингибиторы всасывания питательных веществ
3.5
Катетеры гастроэнтерологические и сопутствующие изделия
3.6
Катетеры перитонеальные и сопутствующие изделия
3.7
Мониторы/мониторные системы гастроэнтерологические
3.8
Операционные столы проктологические
3.9
Расширители пищевода
3.10 Рестрикторы желудочные и сопутствующие изделия
3.11
Стенты билиарные/панкреатические
3.12 Стенты пищеводные
3.13 Трубки гастроэнтерологические и сопутствующие изделия
3.14 Устройства стомирования и сопутствующие изделия
3.15 Эндоскопы гастроэнтерологические
3.16 Прочие гастроэнтерологические медицинские изделия
50
Группа 14. Подгруппа «Стенты для коронарных артерий»
14. Сердечно-сосудистые медицинские изделия
14.18. Протезы сердечно-сосудистые и сопутствующие изделия
Стенты коронарные стальные
218190 Стент для коронарных артерий
металлический непокрытый
Стенты коронарные кобальт-хромовые
135820 Стент для коронарных артерий
Система для имплантации саморассасывающегося
рассасывающийся выделяющий
стентирующего каркаса ABSORB
лекарственное средство
Стент коронарный CoStar с системой доставки
155760 Стент для коронарных артерий
выделяющий лекарственное средство,
Стент коронарный с лекарственным покрытием
с рассасывающимся полимерным
Cоroflex Please
покрытием
Стент коронарный EXCEL с покрытием Рапамицин
Стент коронарный XIENCE V с системой доставки
155800 Стент для коронарных артерий
выделяющий лекарственное средство,
Стент коронарный Xience Хpedition с лекарственным
покрытием эверолимус
с нерассасывающимся полимерным
покрытием
Стент коронарный, сиролимус-элюирующий Раrtner

Группа 10: Тотальные эндопротезы тазобедренного сустава
10. Ортопедические медицинские изделия
10.15. Протезы суставов имплантируемые и сопутствующие изделия
214680 Эндопротез тазобедренного сустава тотальный
с парой трения металл-полиэтилен
214690 Эндопротез тазобедренного сустава тотальный
с парой трения металл-металл
218500 Эндопротез тазобедренного сустава тотальный
с парой трения керамика-керамика
218510 Эндопротез тазобедренного сустава тотальный
с парой трения керамика-полиэтилен
218520 Эндопротез тазобедренного сустава тотальный с парой трения
керамика-металл

Реагенты для in vitro диагностики на приборе
БиоПлекс 2200
5. Медицинские изделия для in vitro диагностики (ИВД)
5.04. Реагенты/наборы для определения аналитов ИВД
244300 Treponema pallidum антитела класса
иммуноглобулин G (IgG) ИВД, реагент
Реагент БиоПлекс 2200 Syphilis IgG
244140 Treponema pallidum антитела класса
иммуноглобулин M (IgM) ИВД, реагент
Реагент БиоПлекс 2200 Syphilis IgM
244070 Treponema pallidum антитела класса
иммуноглобулин M (IgM) ИВД, калибратор
Калибратор БиоПлекс 2200 Syphilis IgM
244110 Treponema pallidum антитела класса
иммуноглобулин M (IgM) ИВД,
Контроль БиоПлекс 2200 Syphilis IgM
контрольный материал
Отнесение к видам номенклатурной классификации
медицинских изделий
¾ Каждое медицинское изделие должно найти свой вид в номенклатурной
классификации медицинских изделий. Одному медицинскому
изделию должен соответствовать только один вид номенклатурной
классификации медицинских изделий.
¾ Если возникают сложности при отнесении медицинского изделия к виду
номенклатурной классификации медицинских изделий, то при подаче
заявления о регистрации медицинского изделия или о внесении
изменений в регистрационное удостоверение, необходимо приложить
обращение в адрес Росздравнадзора с просьбой подобрать
соответствующий вид номенклатурной классификации медицинских
изделий.

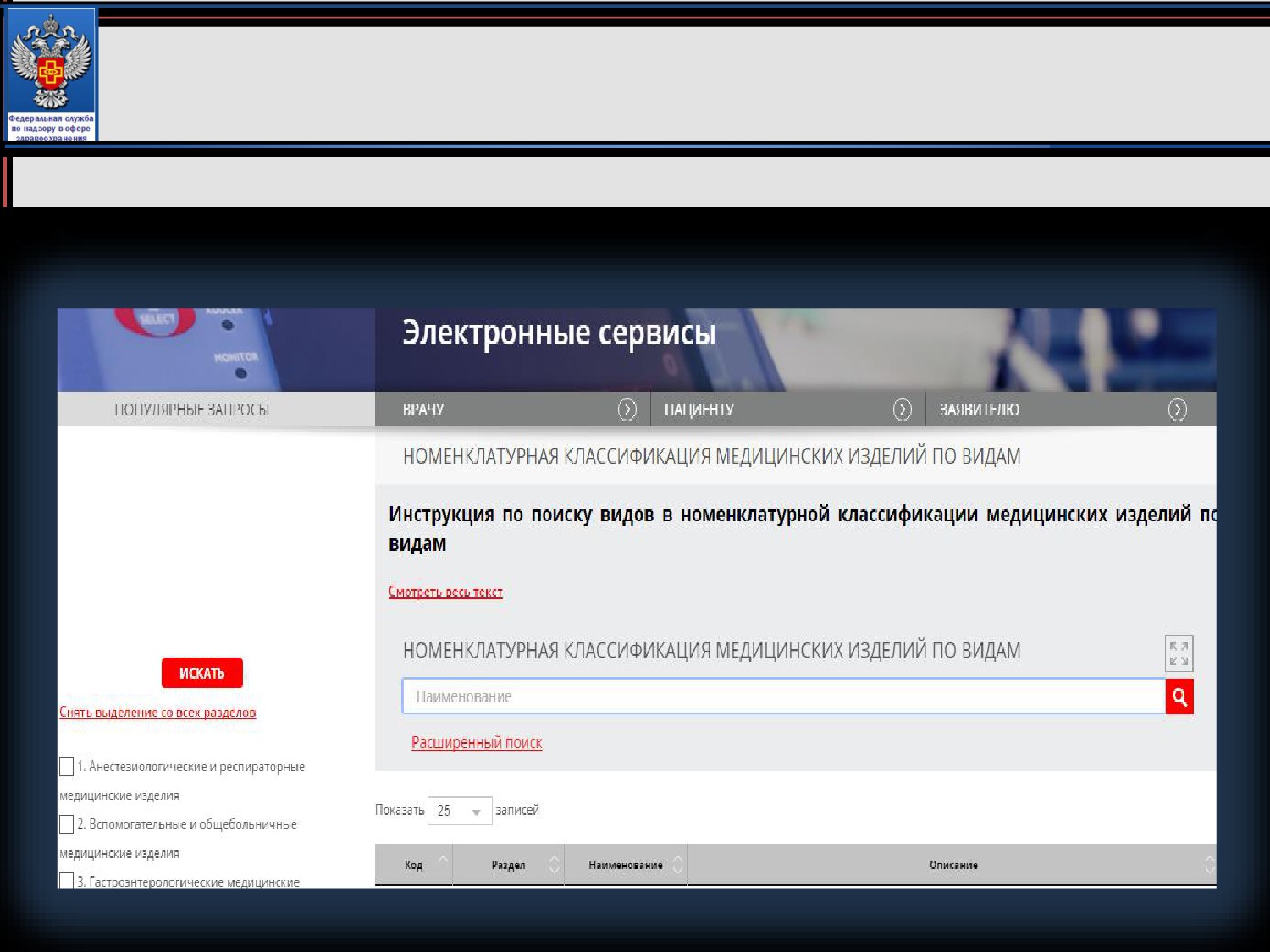
Инструкция по поиску видов в номенклатурной
классификации медицинских изделий
Номенклатурная классификация медицинских изделий по
видам размещается в электронном виде на официальном сайте
Федеральной службы по надзору в сфере здравоохранения в
информационно-телекоммуникационной сети
«Интернет» в
разделе «Электронные сервисы»
Инструкция по поиску видов в номенклатурной
классификации медицинских изделий
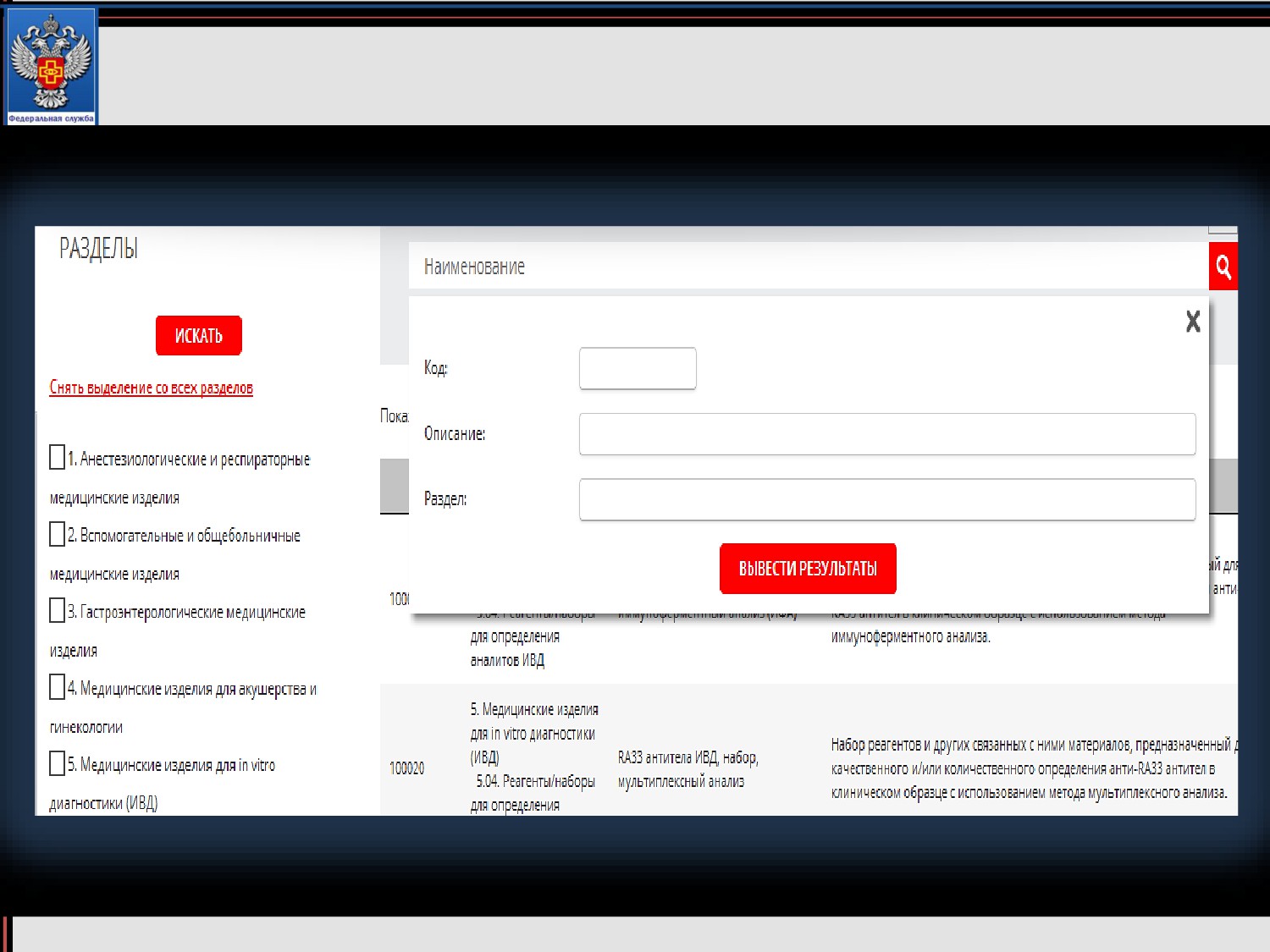
Инструкция по поиску видов в номенклатурной классификации
медицинских изделий
Расширенный поиск

Пример 1. Имплантируемый кардиовертер-дефибриллятор
Поиск по наименованию
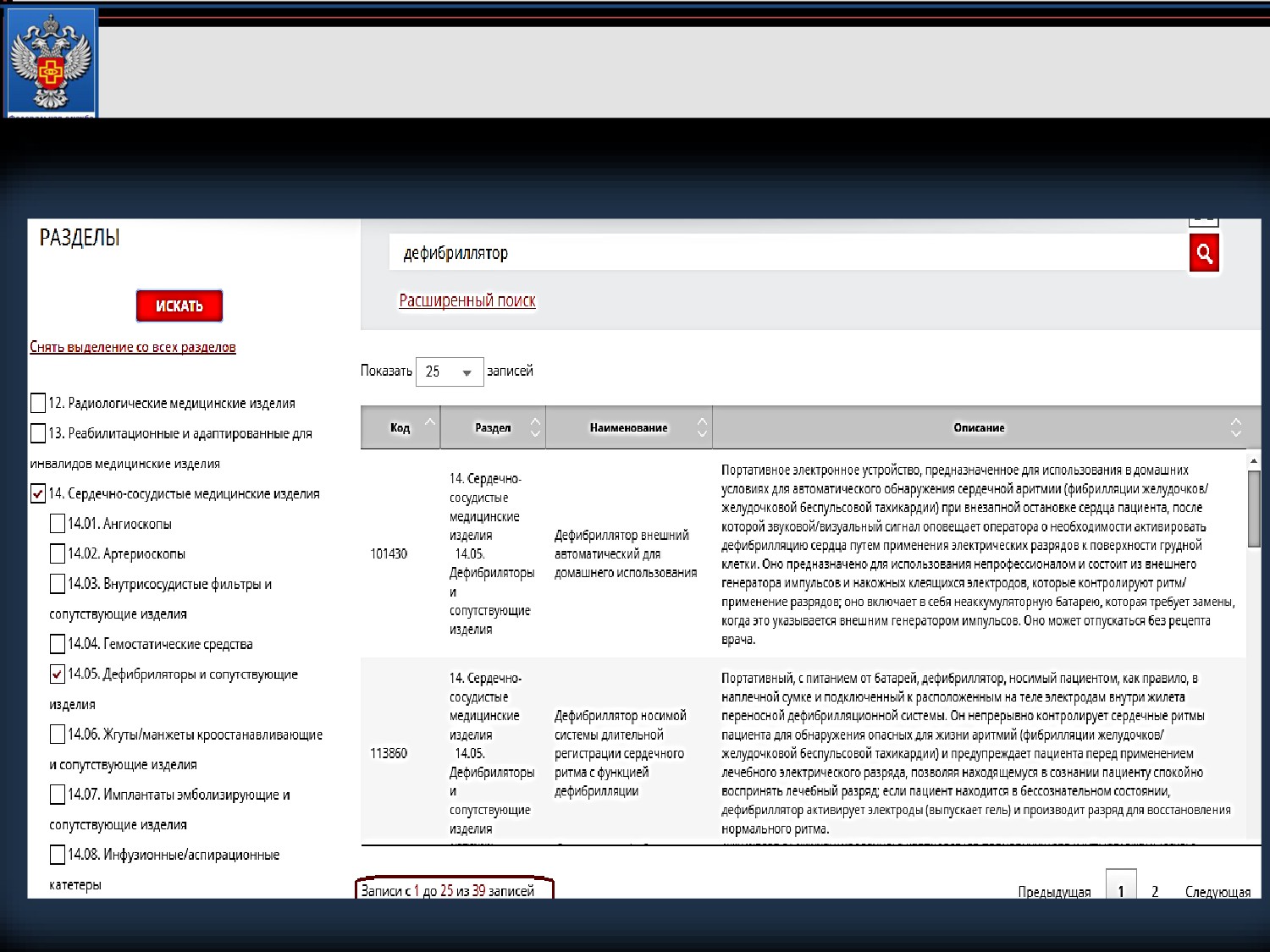
Пример 1. Имплантируемый кардиовертер-дефибриллятор
Поиск по наименованию + фильтр по разделу
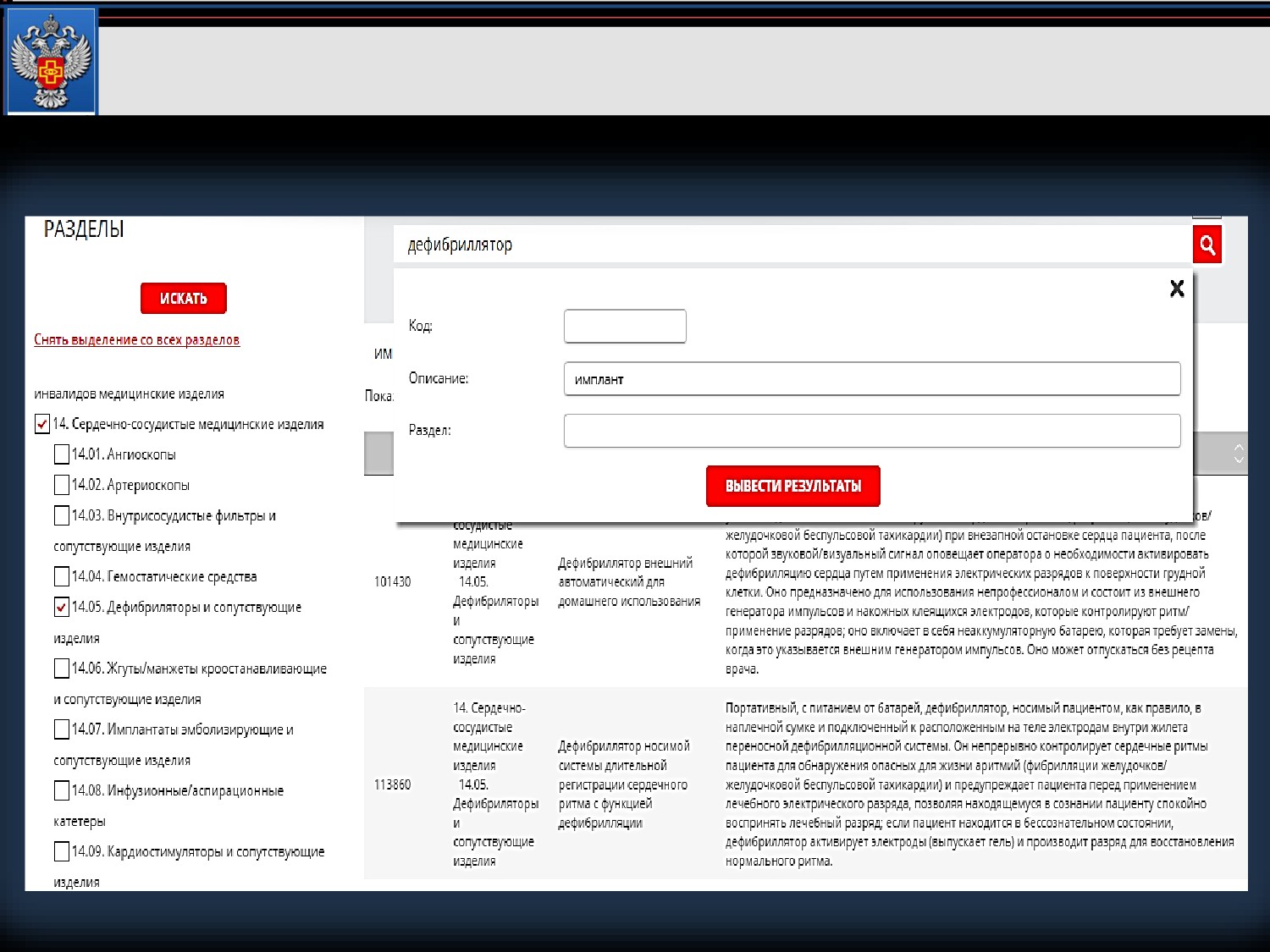
Пример 1. Имплантируемый кардиовертер-дефибриллятор
Поиск по наименованию + фильтр по разделу + ключевое слово

Пример 1. Имплантируемый кардиовертер-дефибриллятор
Поиск по наименованию + фильтр по разделу + ключевое слово
в описании
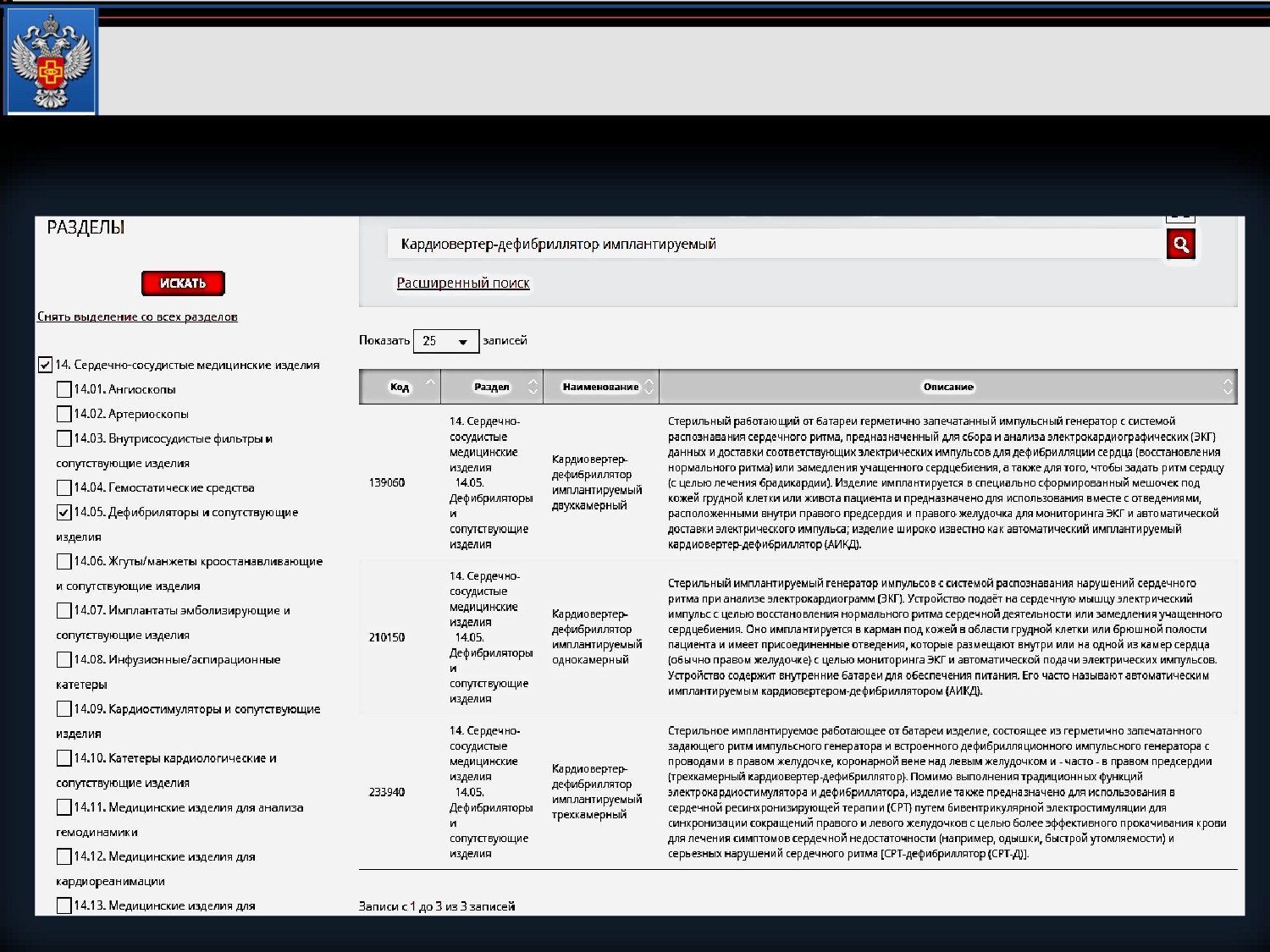
Пример 1. Имплантируемый кардиовертер-дефибриллятор
Поиск по развернутому наименованию

Пример 2. Кювез для новорожденных
Поиск по наименованию. Выбор ключевого слова

Пример 2. Кювез для новорожденных
Поиск по наименованию. Выбор ключевого слова
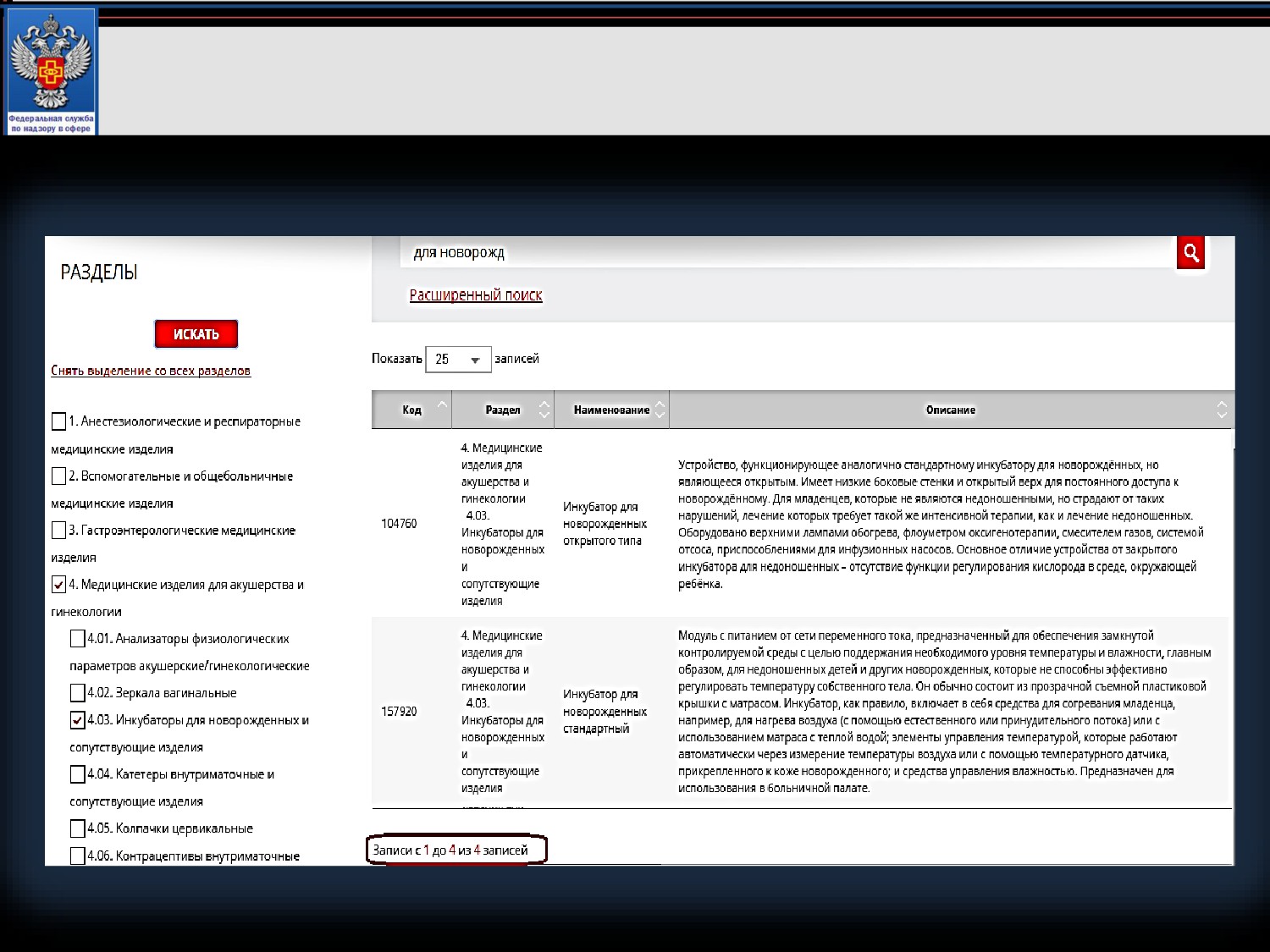
Пример 2. Кювез для новорожденных
Поиск по наименованию + фильтр по разделу
Рекомендуемая структура
технической документации
на медицинское изделие
Часто встречающиеся недостатки
Требования к содержанию технической документации
Требования к технической документации установлены в пункте 4
Правил государственной регистрации медицинских изделий,
утвержденных постановлением Правительства Российской
Федерации от 27.12.2012 № 1416:
"техническая документация"
- документы, регламентирующие
конструкцию медицинского изделия, устанавливающие
технические требования и содержащие данные для его
разработки,
производства,
применения,
эксплуатации,
технического обслуживания,
ремонта, утилизации или
уничтожения
Содержание документа (документов) должно соответствовать
этому понятию. Вся информация должна предоставляться по
применимости по отношению к конкретному медицинскому
изделию
68

Требования к содержанию технической документации
Техническая документация - это документ или документы, содержащие
следующую информацию:
- сведения регламентирующие конструкцию медицинского изделия
- технические требования к медицинскому изделию
- данные для разработки и производства медицинского изделия
- данные для применения и эксплуатации медицинского изделия
-данные для технического обслуживания и ремонта медицинского
изделия
-данные для утилизации или уничтожения МИ
69

Примеры
технической документации отечественного производителя
Технические условия, технологический регламент
Документы по валидации процесса стерилизации
Акты квалификационных испытаний, Сертификаты системы
менеджмента качества разработки, производства,
Результаты предварительной работы при разработке
медицинского изделия (НИР, НИОКР)
70

Примеры
технической документации зарубежного производителя
Технический файл или выписка из технического файла
Документы по валидации процесса стерилизации
Сертификаты системы менеджмента качества
разработки, производства
Юридические документы, подтверждающие наличие у
производителя официальной регистрации в стране
71

Сведения, регламентирующие конструкцию
медицинского изделия
- состав изделия
- взаимосвязь частей, принадлежностей и комплектующих
- описание конструктивных особенностей
- взаимосвязь с другими медицинскими изделиями
- особенности управления
- имеющиеся потенциальные опасности
72

Технические требования к медицинскому изделию
-
требования,
определяющие
функциональные
характеристики
(характеристики
качества)
и
характеристики безопасности:
- функциональные характеристики изделия должны
содержать требования, влияющие на его способность
действовать по назначению
-
характеристики безопасности должны содержать
требования, определяющие степень опасности изделия, а
также классификационные сведения в части безопасности
73

Данные для разработки и производства медицинского изделия
В качестве данных для разработки и производства изделия могут служить
документы, содержащие сведения подтверждающие право разработчика на
разработку конкретных изделий или видов изделий:
- регистрационные свидетельства страны разработчика
- сертификаты соответствия системы менеджмента качества
- декларации о соответствии системы менеджмента качества
- номера конструкторской и/или технологической документации
- Результаты квалификационных испытаний регистрируемого медицинского
изделия (Акт и протоколы) для отечественного производителя
74

Данные для применения и эксплуатации медицинского изделия
- описание условий и особенностей применения
- порядок применения и (или) эксплуатации
- возможные риски при использовании медицинского изделия по
назначению в условиях, предусмотренных производителем
- требования к условиям эксплуатации, в том числе по
устойчивости МИ к климатическим и механическим воздействиям
- срок эксплуатации (срок годности, срок хранения)
- кратность применения и т.п.
75

Данные для технического обслуживания и ремонта
медицинского изделия
- необходимость и возможность технического обслуживания
- порядок технического обслуживания
- регламент и периодичность технического обслуживания (в т.ч.
поверки и/или калибровка средств измерений и измерительных
каналов)
- необходимость ремонта (ремонтопригодность)
- сведения об организациях, имеющих право производить ремонт
76

Данные для утилизации и уничтожения медицинского изделия
- сведения об особенностях и порядке утилизации или уничтожения
самих медицинских изделий, а также их частей и принадлежностей
- особенности утилизации, если изделие нельзя утилизировать в
качестве бытовых отходов
- при необходимости - сведения обо всех опасностях, которые
могут возникнуть при нарушении правил утилизации
ВНИМАНИЕ: СВЕДЕНИЯ ОБ УТИЛИЗАЦИИ (УНИЧТОЖЕНИИ)
УКАЗЫВАЮТСЯ ДЛЯ ВСЕХ МЕДИЦИНСКИХ ИЗДЕЛИЙ БЕЗ
ИСКЛЮЧЕНИЯ
77
Рекомендуемая структура
эксплуатационной документации
на медицинское изделие.
Основные недостатки
Определение понятия «Эксплуатационная документация»
В соответствии с п. 4
Правил государственной регистрации медицинских
изделий, утвержденных постановлением Правительства Российской
Федерации от 27.12.2012 № 1416:
«Эксплуатационная документацияª - документы производителя (изготовителя):
¾ предназначенные для ознакомления потребителя с конструкцией медицинского
изделия,
¾ регламентирующие условия и правила эксплуатации
(использование по
назначению, техническое обслуживание, текущий ремонт, хранение и
транспортировка),
¾ гарантированные производителем значения основных параметров, характеристик
(свойств) медицинского изделия,
¾ гарантийные обязательства,
¾ сведения об утилизации или уничтожении.
80

Виды эксплуатационной документации на медицинское изделие
РУКОВОДСТВО ПО ЭКСПЛУАТАЦИИ
РУКОВОДСТВО ПОЛЬЗОВАТЕЛЯ (ДЛЯ ПРОГРАММНОГО ОБЕСПЕЧЕНИЯ)
ИНСТРУКЦИЯ ПО ЭКСПЛУАТАЦИИ
РУКОВОДСТВО/ИНСТРУКЦИЯ ПО МОНТАЖУ
ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ, ЭТИКЕТКА
ПАСПОРТ
ФОРМУЛЯР
Эксплуатационная документация на медицинское изделие
Подпунктом «г)ª пункта
10 Правил государственной регистрации
медицинских изделий, утвержденных постановлением Правительства
Российской Федерации от 27.12.2012 № 1416, определено:
«Для
государственной
регистрации
предоставляется
«эксплуатационная документация на медицинское изделие, в том
числе инструкция по применению или руководство по
эксплуатации медицинского изделия».
82

Виды эксплуатационной документации на медицинское изделие
Руководство
Инструкция по
(Инструкция) по
Руководство
Формуляр
применению,
эксплуатации,
пользователя ПО
Этикетка
Паспорт
Для медицинского
изделия
Для
Вспомогательный
длительного
медицинского
документ к
Для программного
многоразового
изделия
Руководству по
обеспечения (ПО)
применения
однократного
эксплуатации или
(может быть
(аппараты,
применения -
к паспорту
включено в
приборы,
после
(обычно для
основное
оборудование,
использования
изделий, которые
руководство по
устройства,
наступает
имеют сложный
эксплуатации)
системы,
утилизация
состав)
8
комплексы и т.п.)
(уничтожение)

Рекомендуемая структура Руководства по эксплуатации
Информация об изделии
Описание и работа
Эксплуатация медицинского изделия
Техническое обслуживание и текущий ремонт
Хранение и транспортирование
Гарантийные обязательства
Утилизация
84

Рекомендуемая структура эксплуатационной документации
на медицинское изделие
Информация об изделии
Наименование и обозначение
Производитель медицинского
медицинского изделия
изделия
85

Рекомендуемая структура эксплуатационной документации на
медицинское изделие
Описание и работа
Краткие сведения о медицинском изделии;
Гарантированные производителем технические параметры и характеристики
зделия
Состав (комплектность поставки) медицинского изделия
Предупреждения, меры предосторожности и ограничения при использовании
медицинского изделия
Описание упаковки, маркировки и предупреждающих надписей на изделии
86

Рекомендуемая структура эксплуатационной документации
на медицинское изделие
Эксплуатация медицинского изделия
Установка и ввод в эксплуатацию
Порядок работы (использование изделия по назначению)
Порядок действи
применении медицинского изделия с
Порядок контроля
описанием режимов работы и
работоспособности медицинского
информации отображаемой на
изделия
дисплее
87

Рекомендуемая структура эксплуатационной документации
на медицинское изделие
Техническое обслуживание
Содержание и периодичность технического обслуживания, включая очистку и
дезинфекцию медицинского изделия
Расходные материалы (компоненты) медицинского изделия и процедура их
замены
Калибровка в течение срока эксплуатации МИ
88
Рекомендуемая структура эксплуатационной документации
на медицинское изделие
Текущий ремонт
Сведения, необходимые для проведения текущего ремонта изделия и его
составных частей в условиях эксплуатации
Сведения об организациях, имеющих право производить ремонт
Перечень возможных неисправностей и рекомендации по действиям при их
возникновении
Указания по поиску и устранению последствий отказов
89

Рекомендуемая структура эксплуатационной документации
на медицинское изделие
Утилизация
Инфекционная или микробная опасность медицинского изделия
Экологическая опасность медицинского изделия
Физическая опасность медицинского изделия
90
Порядок проведения технических
испытаний.
Основные замечания к документам,
подтверждающим результаты
технических испытаний
Понятие
«технические испытания медицинских изделий»
В пункте 4 Правил государственной регистрации медицинских
изделий, утвержденных постановлением Правительства
Российской Федерации от 27.12.2012 № 1416, установлено:
"технические испытания" - испытания с целью определения
соответствия характеристик (свойств) медицинского изделия
требованиям нормативной документации, технической и
эксплуатационной
документации
производителя
(изготовителя) и принятия последующего решения о
возможности проведения клинических испытаний.
93
Нормативно-правовые акты в области проведения технических
испытаний медицинских изделий
Приказ Минздрава России от 09.01.2014 № 2н «Об утверждении
Порядка проведения оценки соответствия медицинских изделий
в форме технических испытаний, токсикологических
исследований, клинических испытаний в целях государственной
регистрации медицинских изделий» устанавливает требования к
проведению оценки соответствия медицинских изделий, которая
проводится в форме технических испытаний«. медицинских
изделий в целях государственной регистрации медицинских
изделий.
Производитель медицинского изделия или уполномоченный
представитель производителя
(заявитель) самостоятельно
определяет испытательную организацию, осуществляющую
проведение технических испытаний.
94
Порядок проведения
технических испытаний медицинских изделий
В п. 5 приказа Минздрава России от 09.01.2014 № 2н установлено:
«Технические испытания медицинских изделий проводятся в
форме испытаний и
(или) оценки и анализа данных
(далее
соответственно
- испытания, оценка и анализ данных) для
проверки качества и безопасности медицинского изделия при
использовании его в соответствии с назначением,
предусмотренным документацией производителя».
В п. 6 приказа Минздрава России от 09.01.2014 № 2н установлено:
Технические испытания в форме оценки и анализа данных
проводятся только в отношении медицинских изделий, для
монтажа (ввода в эксплуатацию) которых требуется получение
разрешений
(лицензий), создание специальных условий,
строительство отдельных капитальных сооружений и
дополнительного обучения специалистов, а в некоторых случаях -
выезд на место производства медицинского изделия.
95
Порядок проведения
технических испытаний медицинских изделий
В рамках оценки и анализа данных проводятся:
¾ Анализ данных технической литературы и информации,
относящейся к безопасности, эксплуатационным и техническим
характеристикам, а также к предусмотренному применению
медицинского изделия.
¾ Анализ результатов проведенных испытаний медицинского
изделия.
¾ Анализ условий производства медицинского изделия.
96
Состав документов,
необходимых для проведения технических испытаний
В п. 9 приказа Минздрава России от 09.01.2014 № 2н установлен перечень
документов, которые предоставляет Заявитель для проведения технических
испытаний, в числе которых указаны:
¾ Копии протоколов предварительных испытаний МИ.
¾ Копии результатов технических испытаний МИ, проведенных за
пределами Российской Федерации (при наличии).
¾ Сведения о нормативной документации на МИ.
¾ Техническую и эксплуатационную документацию производителя на МИ.
¾ Фотографические изображения общего вида МИ вместе с
принадлежностями.
¾ Необходимые для технических испытаний рабочие чертежи, таблицы,
схемы, если они содержатся в эксплуатационной документации
производителя.
¾ Специальное оборудование, разработанное производителем для
технических испытаний конкретного МИ и указанное им в технической
документации (при наличии).
В случае если оригиналы документов составлены на иностранном языке,
они представляются с заверенным переводом на русский язык
97

Состав документов,
подтверждающих результаты технических испытаний
Акт результатов технических испытаний медицинского изделия и
Приложения к нему:
¾ фотографическое изображение общего вида медицинского изделия;
¾ утвержденная программа технических испытаний медицинского изделия;
¾ протоколы технических испытаний или оценки и анализа данных.
ВНИМАНИЕ!
Приложения -
неотъемлемая
часть Акта
98

Состав документов,
подтверждающих результаты технических испытаний
Акт
Программа
технических
Фотографии
испытаний
Протоколы
Протоколы
Протоколы
испытаний
собственных
испытаний
сторонней
испытаний
лаборатории
лаборатории
производителя
99
Состав документов,
подтверждающих результаты технических испытаний
¾ Акт оценки результатов технических испытаний медицинского изделия
оформляется испытательной лабораторией
в соответствии с
Приложением 1 приказа Минздрава России от 09.01.2014 № 2н.
¾ Программа технических испытаний
-
составляется совместно с
заявителем, утверждается руководителем испытательной организации,
проводящей технические испытания.
¾ Протоколы технических испытаний выполняются испытательной
лабораторией,
сторонней
испытательной
лабораторией
или
производителем в соответствии с п.
2
приказа Минздрава России от
09.01.2014 № 2н.
¾ «Технические испытания « осуществляются в соответствии с настоящим
Порядком при соблюдении требований действующего законодательства
Российской Федерации об обращении медицинских изделий,
нормативной, технической документации производителя медицинского
изделия, а также национальных
(международных) стандартов,
содержащих правила и методы исследований (испытаний и измерений)
медицинских изделий»
100

Структура
Программы технических испытаний медицинского изделия
- вводная часть;
- рассмотрение технической документации;
- перечень экспериментальных проверок и
исследований образцов;
- оформление результатов испытаний;
- приложения.
101

Структура и содержание протоколов испытаний
(рекомендуемая)
ГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных
и калибровочных лабораторий
состав и количество образцов медицинского изделия, использованных при
проведении испытаний, с указанием серийных (заводских) номеров, номеров
партий, серий и т.п.
краткое описание, назначение изделия, его комплектность или состав ) и
перечень поставляемых вместе с ним принадлежностей (предназначенных для
самостоятельного применения), особенности медицинского изделия
обоснование выбора для испытаний испытываемого медицинского изделия
перечень представленных вместе с медицинским изделием на технические
испытания документов
перечень испытательного оборудования и средств измерения, используемых
испытательной лабораторией (центром) при проведении испытаний
процедура проводимых испытаний, ссылка на программу испытаний и порядок
их проведения, место и условия проведения испытаний

Структура и содержание протоколов испытаний
(рекомендуемая)
- результаты проведенных испытаний медицинского изделия и его
принадлежностей по перечню стандартов, нормативных
документов,
определенных программой испытаний и
перечисленных на титульном листе протокола испытаний,
указываются замеряемые параметры, приводятся результаты
статистической обработки полученных результатов и критерии их
приемки
- классификация медицинских изделий
- заключение о полноте проведенных испытаний медицинского
изделия в соответствии с программой, о соответствии
медицинского изделия действующим стандартам, заявленным
требованиям и нормативным документам
- ссылка на приложения к протоколу испытаний
- сведения об испытателях
Подтверждение качества - примеры стандартов
ГОСТ Р 50444-92
Приборы, аппараты и оборудование медицинские. Общие
технические условия
ГОСТ 19126-2007
Инструменты медицинские металлические. Общие
технические условия
ГОСТ ISO 7886-1-2011
Шприцы инъекционные однократного применения
стерильные. Часть 1. Шприцы для ручного использования
ГОСТ Р 51219-98
Изделия медицинские эластичные фиксирующие и
компрессионные. Общие технические требования.
Методы испытаний

Подтверждение безопасности - примеры стандартов
ГОСТ Р МЭК 60601-1-2010
Изделия медицинские электрические. Часть 1. Общие требования
безопасности с учетом основных функциональных характеристик
ГОСТ Р 50267.0-92
Изделия медицинские электрические. Часть 1. Общие требования
безопасности
ГОСТ 12.2.091-2012
Безопасность электрического оборудования для измерения,
управления и лабораторного применения. Часть 1. Общие требования
ГОСТ Р МЭК 60601-1-2-2014 Изделия медицинские электрические. Часть 1-2.
Общие требования безопасности с учетом основных функциональных
характеристик. Параллельный стандарт. Электромагнитная совместимость.
Требования и испытания
ГОСТ Р 51522.1-2011
Совместимость
технических
средств
электромагнитная.
Электрическое оборудование для измерения, управления и
лабораторного применения. Часть 1. Общие требования и методы
испытаний
Порядок проведения токсикологических
исследований.
Часто встречающиеся замечания к
документам, подтверждающим
результаты токсикологических
исследований

Нормативно-правовое регулирование проведения
токсикологических исследований
Приказ Минздрава РФ от 09.01.2012 № 2н
«Об утверждении Порядка проведения
оценки
соответствия
медицинских
изделий в форме технических испытаний,
токсикологических
исследований,
клинических
испытаний
в
целях
государственной
регистрации
медицинских изделийª.

Цель проведения токсикологических исследований
медицинских изделий
Токсикологические исследования медицинского изделия
проводятся для оценки биологического действия медицинского
изделия на организм человека.
в себя
санитарно-химических
проверку
следующих
показателей:
биологических в
условиях in vitro и in vivo
Перечень документов, представляемых заявителем в
испытательную организацию для проведения
токсикологических исследований
а) заявление о проведении токсикологических исследований;
б) образцы
(образец) медицинского изделия или принадлежности, к медицинскому
изделию, контактирующие с поверхностью тела человека, или материалы, из которых
произведены (изготовлены) медицинское изделие и (или) принадлежности к медицинскому
изделию, контактирующие с поверхностью тела человека;
в) сведения о нормативной документации на медицинское изделие;
г) техническую и эксплуатационную документацию производителя с перечнем
национальных
(международных) стандартов, требованиям которых соответствует
медицинское изделие (при их применении производителем);
д) сведения о нормативной документации на материалы, из которых произведены
(изготовлены) медицинские изделия и (или) принадлежности к медицинскому изделию;
е) номер фармакопейной статьи, а при ее отсутствии номер нормативной документации или
нормативного документа на фармацевтическую субстанцию или на лекарственный
препарат, включенную(ый) в государственный реестр лекарственных средств (в случае
применения в составе медицинского изделия лекарственного средства)
ж) документы, характеризующие состав материалов, из которых произведены
(изготовлены) медицинское изделие и (или) принадлежности к медицинскому изделию,
контактирующие с поверхностью тела человека;
з) копии результатов токсикологических испытаний
(испытаний на биосовместимость)
медицинских изделий, проведенные за пределами Российской Федерации (при наличии).
В случае если оригиналы документов составлены на иностранном языке, они
представляются с заверенным переводом на русский язык.
110
При проведении токсикологических исследований
осуществляются:
¾ идентификация медицинского изделия (материала);
¾классификация медицинского изделия;
¾ определение длительности контакта медицинского изделия с
организмом человека;
¾ анализ представленной документации на медицинское изделие;
¾ составление программы токсикологических исследований;
¾ проведение исследований медицинского изделия;
¾оформление и выдача (вручение или направление заказным
почтовым отправлением с уведомлением о вручении) заявителю
заключения по результатам токсикологических исследований
медицинского изделия.
111
Медицинские изделия, в отношении которых проводятся
токсикологические исследования
Согласно приказу Минздрава России от 09.01.2014 № 2н «Об утверждении
Порядка проведения оценки соответствия медицинских изделий в форме
технических испытаний, токсикологических исследований, клинических
испытаний в целях государственной регистрации медицинских изделий»
токсикологические исследования медицинского изделия проводятся в
отношении изделия, контактирующего с организмом человека при
использовании его в соответствии с назначением, предусмотренным
документацией производителя:
а) медицинское изделие и (или)
б) медицинское изделие,
принадлежности к медицинскому
временно вводимое в организм
изделию, контактирующие с
человека извне;
поверхностью тела человека;
в) медицинское изделие,
имплантируемое в организм человека
Медицинские изделия, в отношении которых проводятся
токсикологические исследования (ГОСТ 31214-2003)
Медицинские изделия по виду контакта с организмом человека
подразделяют на несколько групп.
Изделия, контактирующие непосредственно или опосредованно:
¾ с внутренней средой организма
¾ с кровью и лимфой
¾ с раневой поверхностью
¾ со слизистыми оболочками
¾ с кожей
Медицинские изделия в зависимости от длительности контакта с
организмом человека подразделяют на:
¾ изделия, постоянно
(пожизненно) или длительно
(более суток)
контактирующие с организмом
¾ изделия, кратковременно контактирующие с организмом человека
(до суток).
113
Программа испытаний токсикологических испытаний
медицинских изделий
Программа токсикологических исследований составляется
испытательной организацией совместно с заявителем и
утверждается руководителем испытательной организации,
проводящей токсикологические исследования (Приказ Минздрава
России от 09.01.2014 №2н)
Программу испытаний медицинских изделий
(материалов)
составляют специалисты, проводящие испытания; программа
определяется характером и продолжительностью контакта
изделия с организмом человека, химической природой
материалов, технологией изготовления изделий, способом
стерилизации изделия (ГОСТ 31214-2003)
114
Межгосударственный стандарт
изделия медицинские. Оценка биологического действия
медицинских изделий
Соблюдение положений стандартов серии ISO
10993
"Оценка
биологического действия медицинских изделий" позволит обеспечить
системный подход к исследованию биологического действия медицинских
изделий.
Целью этих стандартов не является безусловное закрепление
единообразных методов исследований и испытаний за группами
однородных медицинских изделий в соответствии с принятой
классификацией их по виду и длительности контакта с организмом
человека. Поэтому планирование и проведение исследований и испытаний
должны осуществлять специалисты, имеющие соответствующую
подготовку и опыт в области санитарно-химической, токсикологической и
биологической оценок медицинских изделий.
Стандарты серии ISO 10993 являются руководящими документами для
прогнозирования и исследования биологического действия медицинских
изделий на стадии выбора материалов, предназначенных для их
изготовления, а также для исследований готовых изделий.
115

1 этап: Санитарно-химические исследования
¾ Санитарно-химические исследования позволяют отбраковывать
непригодную к применению в клинической практике продукцию.
¾ Результаты испытаний этого этапа
могут быть основанием для
прекращения
дальнейших
исследований
изделия
или
позволят осуществить коррекцию
в
подборе материалов и
технологического
процесса
получения МИ, отвечающего
требованиям безопасности.

Санитарно-химические показатели в оценке безопасности
медицинских изделий (на примере перевязочных средств)
Наименование продукции
Санитарно-химические показатели
Допустимые уровни
(товара)
состояния водных вытяжек
Перевязочные средства,
Запах
не более 1 балла
шовные и
Цветность
не более 20о по шкале
вспомогательные
Мутность
не более 2-х баллов
материалы
рН
в пределах 6-9 ед͘рН
(Повязки, пленки, бинты,
Изменение рН
+-1 ед͘рН
пластыри, гигиенические
Окисляемость
не более 5 мгО2/л
салфетки)
Бромируемость
не более 0,3 мгBr2/л
УФ-поглощение в диапазоне длин
волн 220-360 нм
не более 0,3 ед͘О͘П.
Восстановительные примеси
не более 1,0 мл 0,02Н р-ра Na2S2O3
117

Санитарно-химические показатели в оценке безопасности
медицинских изделий (на примере перевязочных средств)
Повязки, пленки, бинты,
Натуральные волокна:
пластыри, гигиенические
-Формальдегид
не более 0,1 мг/л
салфетки
- Этилацетат
не более 0,1 мг/л
- Ацетон
не более 0,1 мг/л
- Остаточный активный
хлор
Отсутствие
Искусственные волокна
(вискоза, ацетаты):
- ацетальдегид
не более 0,2 мг/л
-формальдегид
не более 0,1 мг/л
118

2 этап: Токсикологические исследования
эксперимент на лабораторных
животных, с целью получение
данных об ответной реакции
2-ой этап оценки безопасности
организма животных на
мед. изделий - собственно
воздействие чужеродного
токсикологические
агента
исследования - включают:
тесты in vitro
на культурах клеток
испытания на стерильность и
апирогенность исследуемого
материала

2 этап: Токсикологические исследования
В ходе токсикологических исследований определяют:
- соответствие медицинского изделия требованиям применимых
национальных
(международных)
стандартов,
нормативной
документации, технической и эксплуатационной документации
производителя;
- соответствие документации требованиям применимых национальных
(международных) стандартов и нормативной документации на
медицинское изделие;
-
полноту и объективность установленных технической и
эксплуатационной документацией производителя характеристик,
подлежащих контролю при токсикологических исследованиях
медицинского изделия, а также методы исследований;
- безопасность применения медицинского изделия.

Токсикологическая оценка состояния водных вытяжек на
примере перевязочных средств
Повязки, пленки, бинты,
Токсикологическая оценка
пластыри, гигиенические
состояния водных вытяжек
салфетки
Раздражающее действие на
кожные покровы
0 баллов
Раздражающее действие на
слизистые оболочки
0 баллов
Сенсибилизирующее действие
0 баллов
121
Результаты токсикологических исследований
По
результатам
испытаний
оформляется
заключение
по
результатам
токсикологических
исследований
медицинского
изделия, форма которого приведена в
приложении № 3 к Приказу Минздрава
России от 09.01.2014 № 2н.
К заключению прилагаются:
¾ протоколы
токсикологических
исследований
медицинского
изделия;
¾ утвержденная
программа
токсикологических
исследований
медицинского изделия.

Медицинское изделие,
представленное в нескольких вариантах исполнения
Если исследуется медицинское изделие,
представленное в нескольких вариантах
исполнения, изготовленных из одного материала
проведение исследования одного варианта
исполнения с распространением выводов на все
варианты исполнения
при этом
в тексте заключения обязательно должна быть
указана фраза:
!
«Результаты токсикологических исследований
!
распространяются на все варианты исполнения изделия»
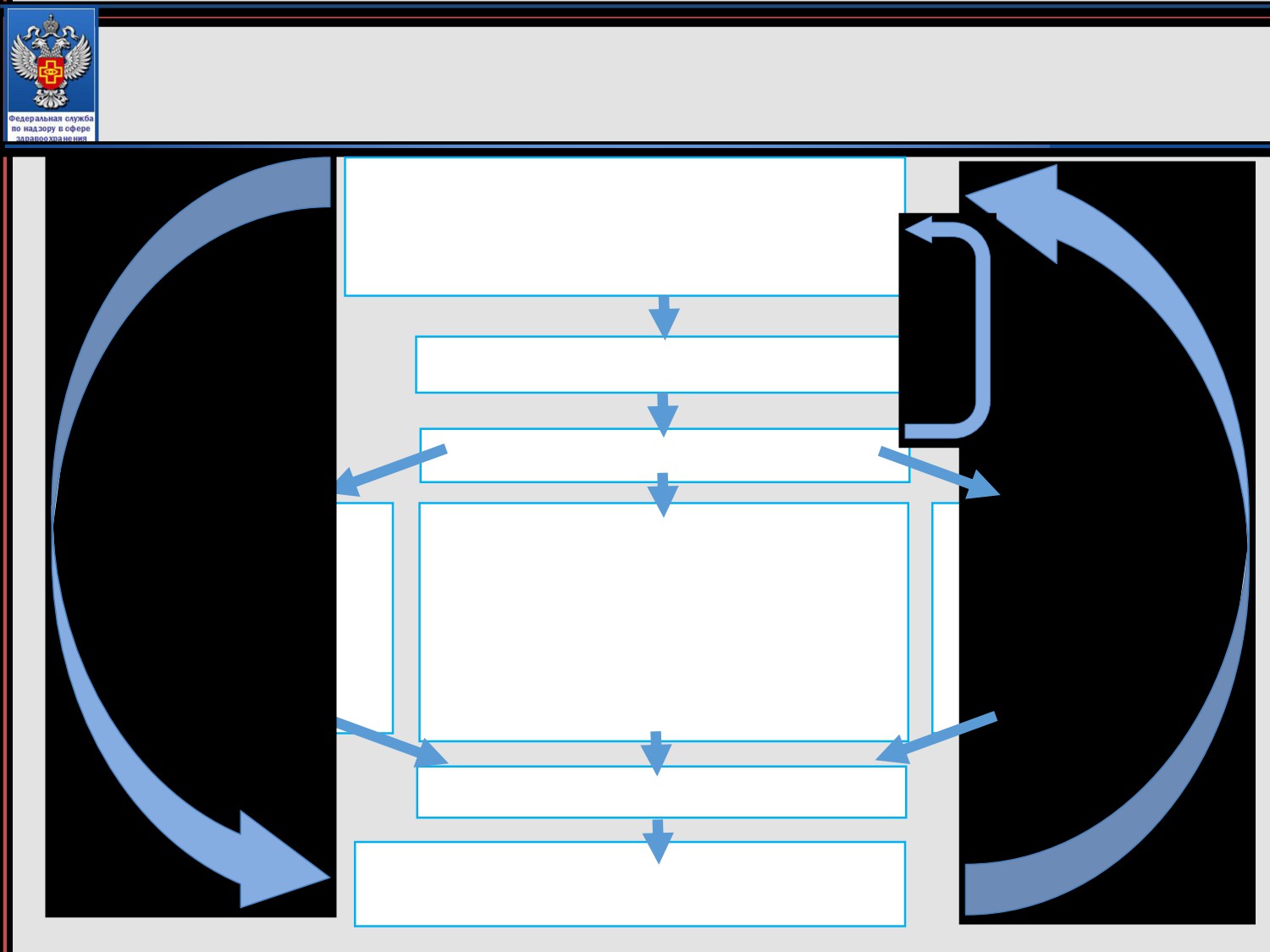
Блок-схема процедуры токсикологического исследования
ГОСТ 31214-2003, стандарты серии ГОСТ ISO
10993, ГОСТ Р 52770-2007, Единые санитарно-
эпидемиологические и гигиенические требования
к
товарам,
подлежащим
санитарно-
эпидемиологическому надзору (контролю)
Составление программы
Отбор образцов
Токсикологические исследования:
Санитарно-химические
Микробиологические
1. Эксперименты на животных с
исследования:
исследования:
применением методов:
• Интегральные
• Определение
• физиологических
показатели
стерильности МИ
• гематологических
• Спектрофотометрия
• Определение
• биохимических
• ВЭЖХ
контаминации
• патоморфологических
• ГЖХ
• иммунологических
• ААС
2. in vitro исследования
Протоколы токсикологических
исследований медицинского изделия
Заключение по результатам
токсикологических исследований
медицинского изделия
Основные нарушения при оформлении
результатов клинических испытаний с
участием человека и в форме оценки и
анализа клинических данных
126
Формы клинических испытаний медицинских изделий
В соответствии с п. 36 Приказа Минздрава России от 09.01.2014 № 2н
«Об утверждении Порядка проведения оценки соответствия
медицинских изделий в форме технических испытаний,
токсикологических исследований, клинических испытаний в целях
государственной регистрации медицинских изделий»:
Клинические испытания медицинских изделий проводятся:
¾ В форме исследований (анализа и оценки клинических данных)
¾ В форме испытаний, в том числе с участием человека
127
Испытания медицинских изделий с участием человека
п. 37 Приказа Минздрава России от 09.01.2014 № 2н
Испытания медицинских изделий с участием человека
проводятся в следующих случаях:
¾ новый вид медицинского изделия;
¾ применение новых сложных и (или) уникальных и (или)
специальных методов профилактики, диагностики и лечения
заболеваний и состояний, а также применение новых
сложных медицинских технологий;
¾ если при проведении анализа и оценки клинических данных не
подтверждены эффективность и безопасность медицинского
изделия
128

Перечень медицинских организаций, имеющих право
проводить клинические испытания медицинских изделий
п. 27 Правил государственной регистрации медицинских изделий,
утвержденных Постановлением правительства Российской Федерации
от 27.12.2012 № 1416
Перечень медицинских организаций, имеющих право проводить
клинические испытания медицинских изделий, и реестр выданных
разрешений на проведение клинических испытаний медицинских
изделий опубликовываются и размещаются регистрирующим
органом в установленном им порядке на своем официальном
сайте в информационно-телекоммуникационной сети “Интернет”;
129

Программа клинических испытаний медицинских изделий
п. 39 Приказа Минздрава России от 09.01.2014 № 2н
¾ При рассмотрении медицинским учреждением представленной документации на
медицинское изделие согласовываются программа и продолжительность клинических
испытаний медицинского изделия.
¾ Продолжительность клинических испытаний определяется назначением и сложностью
медицинского изделия.
¾ Программа клинических испытаний составляется заявителем совместно с медицинской
организацией, осуществляющей проведение клинических испытаний медицинского изделия, в
соответствии с требованиями, указанными в технической и эксплуатационной документации
130
производителя, а также требованиями нормативной документации.
Совет по этике
Испытания с участием человека
¾ Проведение клинических испытаний медицинского изделия
с участием человека осуществляется на основании
положительного заключения совета по этике.
п. 41 Приказа Минздрава России от 09.01.2014 № 2н
Приказ Минздрава России от 01.03.2013 № 108 «Об утверждении
состава совета по этике в сфере обращения медицинских
изделий»
131
Руководящие документы
¾ ГОСТ Р ИСО
14155-2014
«Клинические исследования.
Надлежащая клиническая практикаª.
Утвержден и введен в действие Приказом Федерального агентства
по техническому регулированию и метрологии от 04.06.2014 № 497-
ст взамен ГОСТ Р ИСО 14155-1-2008, ГОСТ Р ИСО 14155-2-2008
Область применения (1):
В настоящем стандарте рассмотрена надлежащая клиническая
практика
планирования,
проведения,
документального
оформления и представления результатов клинических
исследований, проводимых с участием человека, для оценки
безопасности или функциональных характеристик медицинских
изделий в целях регулирования.
132
При проведении клинических испытаний осуществляются:
¾ анализ и оценка клинических данных;
¾ оценка сведений о проводившихся клинически значимых
корректирующих действиях;
¾ анализ научной литературы и/или неопубликованных данных,
соотнесенных с применением медицинского изделия и методом
его использования;
¾ составление программы клинических испытаний;
¾ доработка эксплуатационной документации производителя на
медицинское изделие по результатам испытаний
(при
необходимости);
¾ оформление и выдача заявителю акта оценки результатов
клинических испытаний медицинского изделия
п. 43 Приказа Минздрава России от 09.01.2014 № 2н
133
Публикации о клинической эффективности
медицинского изделия
к) документы
(материалы), содержащие данные о
клиническом применении медицинского изделия, в том
числе за пределами Российской Федерации, в том числе
обзоры, отчеты о проведенных научных исследованиях,
публикации, доклады, анализ риска применения, методы
применения медицинского изделия (при наличии).
В случае если оригиналы документов составлены на
иностранном языке, они представляются с заверенным
переводом на русский язык.
п. 38 Приказа Минздрава России от 09.01.2014 № 2н
134
Публикации о клинической эффективности
медицинского изделия
Базы данных для поиска
EMBASE - Escerpta Medica published by Elsevier
CENTRAL - The Cochrane Central Register of Controlled
Trials
MAUDE - US FDA’s Manufacturer And User Facility Device
Experience database
MEDION - Database that indexes literature on diagnostic tests
MEDLINE - Publiched by US National library of Medicine
(Pubmed)
E-library - научная электронная библиотека (РФ)
Scopus, Web of Science
135
Приложения к Акту клинических испытаний
Следует обратить особое внимание, что в качестве приложений Акт
клинических испытаний должен содержать копии всех исследуемых
документов, в том числе:
¾ утвержденная программа клинических испытаний медицинского изделия;
¾ протоколы клинических испытаний или результаты оценки и анализа
данных, включая графики, снимки, выписки из историй болезни,
табулированный, статистически обработанный материал;
¾ подробные данные по использованию медицинских изделий в
медицинской практике, данные отдаленных результатов наблюдения (при
наличии);
¾ эксплуатационная документация на медицинское изделие (инструкция по
медицинскому
применению)
при
клинических
испытаниях
физиотерапевтических аппаратов, реагентов (наборов) для диагностики
(in vitro), медицинских изделий, предназначенных для профилактики,
диагностики, лечения заболеваний в домашних условиях.
137
Сведения о взаимозаменяемых медицинских изделиях
Клинические
Технические
Биологические
Область применения
Условия применения
Материалы и марки
изготовления
Клиническое
целевое
Характеристики
и
Стерильность
назначение
свойства
(например,
прочность на излом,
качество поверхности)
Группы
пациентов
Методы разработки
Инвазивность
(возраст,
физиология,
патология)
Соотношение пользы и
Принципы применения
Биодеградация
риска
138
Клинические испытания медицинских изделий
для диагностики in vitro
Клинические испытания медицинских изделий для
диагностики in vitro проводятся в лабораторных условиях
с применением образцов биоматериала пациентов,
взятых в ходе лечебно-диагностического процесса для
проверки функциональных свойств и (или) эффективности
медицинского изделия при использовании его в соответствии
с
назначением,
предусмотренным
документацией
производителя.
п. 47 Приказа Минздрава России от 09.01.2014 № 2н
139
Результаты клинических испытаний считаются отрицательными:
9
медицинское изделие не соответствует назначению и
показаниям к применению, установленным производителем
в эксплуатационной документации на медицинское
изделие;
9
выявлены побочные действия, не указанные в инструкции
по применению или руководстве по эксплуатации
медицинского изделия, нежелательные реакции при его
применении;
9
установлены факты и обстоятельства, создающие угрозу
жизни и здоровью граждан и медицинских работников при
применении и эксплуатации медицинского изделия.
п. 45 Приказа Минздрава России от 09.01.2014 № 2н
140

Сравнительная таблица различных форм
клинических испытаний
1
Анализ запросов о предоставлении
дополнительных материалов и
сведений и отрицательных результатов
экспертизы качества, эффективности и
безопасности медицинских изделий
143
Постановление Правительства Российской Федерации от
27.12.2012 № 1416 «Об утверждении Правил государственной
регистрации медицинских изделий»
«В случае недостаточности для вынесения экспертом
заключения материалов и сведений, содержащихся в
представленных заявителем заявлении о регистрации и
документах, предусмотренных пунктом
10
настоящих
Правил, эксперт ставит вопрос о представлении ему
необходимых материалов
и
сведений
перед
руководителем экспертного учреждения, который
обращается
с
соответствующим
запросом
в
регистрирующий орган, выдавший задание на проведение
экспертизыª.
144
Постановление Правительства Российской Федерации от
27.12.2012 № 1416 «Об утверждении Правил государственной
регистрации медицинских изделий»
«Основанием для вынесения экспертным учреждением
заключения о невозможности проведения клинических
испытаний медицинского изделия или невозможности
государственной регистрации медицинского изделия
является:
a. несоответствие медицинского изделия требованиям
нормативной, технической и (или) эксплуатационной
документации производителя (изготовителя);
b. отсутствие доказательств безопасности медицинского
изделияª.
145
Постановление Правительства Российской Федерации от
27.12.2012 № 1416 «Об утверждении Правил государственной
регистрации медицинских изделий»
«Основанием для принятия решения об отказе в
государственной регистрации медицинского изделия
является получение регистрирующим органом от
экспертного учреждения заключения по результатам
экспертизы качества, эффективности и безопасности
медицинского изделия, свидетельствующего о том, что
качество и
(или) эффективность и (или) безопасность
регистрируемого медицинского изделия не подтверждены
полученными данными, и
(или) о том, что риск
причинения вреда здоровью граждан и медицинских
работников вследствие применения медицинского
изделия превышает эффективность его применения.
146
Причины формирования запросов
Основание
Пример
Наименование
Несоответствие наименования МИ, а также
медицинского изделия,
сведений о производителе, указанных в
сведения о
заявлении о регистрации и иных
производителе
представленных на экспертизу документах
Документация
1. Несоответствие
назначения
МИ,
производителя
указанного
в
представленных
документах.
2. Отсутствие сведений о конструкции,
технических
характеристиках,
параметрах, свойствах МИ.
3. Отсутствие сведений о МИ, наличие
которых регламентировано нормативной
документацией.
4. Отсутствие иной информации, наличие
которой предусмотрено НПА.
147
Причины формирования запросов
Основание
Пример
Технические
1. В процессе технических испытаний не
испытания
подтверждены параметры и характеристики
изделия, ввиду их отсутствия в документации
производителя.
2. Проведены испытания не по всем пунктам
применимых национальных стандартов.
3.
Проведены испытания не по всем
параметрам, указанным в документации
производителя.
Токсикологические
В документах, содержащих результаты
исследования
токсикологических исследований, указаны
только наименования материалов, без
указания их марок в соответствии с данными
документации производителя.
148
Причины формирования запросов
Основание
Пример
Клинические
В качестве приложений к Акту КИ не
испытания
представлены:
¾ программа КИ МИ;
¾ документы
(материалы),
содержащие
данные о клиническом применении
медицинского изделия, в том числе за
пределами Российской Федерации, в том
числе обзоры, отчеты о проведенных
научных
исследованиях,
публикации,
доклады, анализ риска применения, методы
применения медицинского изделия;
¾ Эксплуатационная документация на МИ при
КИ физиотерапевтических
аппаратов,
реагентов для ин-витро диагностики, а также
МИ, предназначенных для применения в
домашних условиях.
149
Причины для отказа при проведении экспертизы
Основание
Пример
Несоответствие
Изделие:
«Набор
реагентов
для
медицинского
суправитальной окраски осадка мочи.
изделия
Модификация метода Штернгеймера
требованиям
(«Суправитальная окраска осадка мочи»)ª
технической
Не представлены результаты технических
документации
испытаний изделия, в состав которого входит
производителя
реагент красный, состоящий из раствора
родамина В и родамина 6Ж.
Подвергнут испытаниям образец, не
соответствующий сведениям, указанным в
документации производителя, так как в состав
реагента красного включен только раствор
родамина В 1.
150
Причины для отказа при проведении экспертизы
Основание
Пример
Несоответствие
Производителем, в рамках ответа на запрос,
медицинского
были внесены изменения в техническую
документацию, в части уточнения (изменения)
изделия
рецептурного состава медицинского изделия.
требованиям
При этом, соответствующие изменения в
технической
эксплуатационную документацию внесены не
документации
были.
производителя
Внесенные изменения не были подтверждены
соответствующими
(техническими)
испытаниями.
Результаты испытаний, представленные на
экспертизу, подтверждают соответствие ранее
заявленного состава медицинского изделия,
сведения о котором сохранились в
эксплуатационной документации.
Таким образом, соответствие МИ технической
документации не подтверждается.
151
Причины для отказа при проведении экспертизы
Основание
Пример
Несоответствие
Ряд технических характеристик и параметров
медицинского
МИ, указанных в технической документации, не
изделия
соответствуют значениям этих характеристик,
требованиям
отраженных в эксплуатационной документации.
эксплуатационной
Результаты
технических
испытаний
документации
подтверждают
соответствие
образца,
производителя
подвергнутого
испытаниям,
данным
технической документации и свидетельствуют
о несоответствии изделия требованиям
эксплуатационной
документации
производителя.
152

Причины для отказа при проведении экспертизы
Основание
Пример
Несоответствие
1.
Стент коронарный с рассасывающимся
лекарственным покрытием
медицинского
В Протоколе технических испытаний измерены
изделия
габаритные размеры стента
(диаметр
-
4,50
мм,
требованиям
длина
-
48
мм) и сделан вывод о соответствии
нормативной
документации производителя.
документации,
При этом в Технической документации указано:
технической и
диаметр стента составляет 3,50 мм, длина - 13 мм
эксплуатационной
2.
Нити из полидиоксанона стерильные
документации
рассасывающиеся для лифтинга тканей на
производителя
атравматических иглах-носителях
Результаты испытаний:
длина нити составляет
70
мм и сделан вывод о
соответствии
требованиям
документации
производителя.
При этом в документации производителя указано:
длина нити составляет 60 мм.
153

Причины для отказа при проведении экспертизы
Основание
Пример
Несоответствие
1. Электромионейростимулятор низкочастотный
медицинского
импульсный двенадцатиканальный
Согласно техническим условиям электрическая
изделия
прочность изоляции, не менее
30
В, что не
требованиям
соответствует
требованиям
применяемого
нормативной
производителем стандарта ГОСТ
50267.0-92
(не
документации,
менее 500 В, для изделия с питанием менее 50 В).
технической и
эксплуатационно
2. Согласно техническим условиям напряжение
й документации
питания составляет
18
В, что не соответствует
производителя
требованиям п. 3.17 Паспорта (работа от источника
постоянного тока с напряжением от 10 до 16 В).
154
Причины для отказа при проведении экспертизы
Основание
Пример
Несоответствие
В Таблице дополнения к акту и протоколу технических
испытаний указана измеренная прочность изоляции
медицинского
(31,7 В) и сделан вывод о соответствии требованиям
изделия
ТУ.
требованиям
При этом, в другой таблице Протокола технических
нормативной
испытаний указано, что
«Не требуется проверять
документации,
электрическую изоляцию частей, если токи утечки на
технической и
пациента и на корпус не превышают допустимого
эксплуатационной
предела при нормальном состоянии, когда сделано
документации
короткое замыкание между соответствующими частями
производителя
стимулятораª.
Данный вывод подтверждает несоответствие
медицинского изделия требованиям нормативной
документации
(п.
20
ГОСТ
50267.0-92), согласно
которой электрическая прочность изоляции должна
быть не менее 500 В (для изделий с питанием менее 50
В).
155

Причины для отказа при проведении экспертизы
Основание
Пример
Несоответствие медицинского
1. Палатки кислородные
изделия требованиям
Измеренный показатель высоты
нормативной документации,
(171
мм) шейного проема в
технической и эксплуатационной
варианте исполнения изделия
документации производителя
КП4, с оценкой «соответствуетª не
соответствует
данным
технической и эксплуатационной
документаций (175±1,2).
156
Причины для отказа при проведении экспертизы
Основание
Пример
Несоответствие
Стент
коронарный
с
рассасывающимся
лекарственным покрытием
медицинского
В Протоколе технических испытаний сделаны выводы о
изделия требованиям
неприменимости к заявленному медицинскому
нормативной
изделию требований, касающихся сведений, которые
документации,
должны содержаться в Инструкции по применению в
технической и
части
содержания
лекарственных
средств
(вероятность взаимодействия лекарств, получаемых
эксплуатационной
пациентом, с таковыми, выделяемыми стентами;
документации
уведомление о добавках и/или вымываемых
производителя
компонентах; идентификация количества лекарств), а
также сведений о стерильности
(выделенные
прописными буквами надписи
«СТЕРИЛЬНО
- НЕ
СТЕРИЛИЗОВАТЬ
ПОВТОРНО
-
ТОЛЬКО
ОДНОРАЗОВОЕ ИСПОЛЬЗОВАНИЕª). Данные выводы
не соответствуют действительности, поскольку
медицинское изделие является стерильным и имеет
лекарственное покрытие.
157
Причины для отказа при проведении экспертизы
Основание
Пример
Не подтверждена
Инструменты стоматологические алмазные
безопасность
абразивные
Не представлены результаты токсикологических
изделия
исследований
головок
стоматологических
алмазных покрытых алмазным порошком марок А
и/или АС по ГОСТ
9206, дисков алмазных
изготовленных из латуни покрытых защитно-
декоративным покрытием Н6 по ГОСТ 9.306.
Не представлены результаты токсикологических
исследований медицинских изделий, покрытых
дополнительным покрытием нитрида титана
(Т)
и/или черного хрома (Х).
158

Причины для отказа при проведении экспертизы
Основание
Пример
Не подтверждена
1. В представленном Заключении по
безопасность
результатам
токсикологических
изделия
исследований, сведения о материалах
представленных
для
проведения
испытаний, не соответствуют данным,
указанным в Выписке из технического
файла и Руководстве по применению
2. Токсикологические исследования не
подтверждают безопасность МИ, ввиду
выявленного несоответствия информации
о материалах, указанных в технической и
эксплуатационной
документации
производителя.
159
Причины для отказа при проведении экспертизы
Основание
Пример
Некорректно выбрана форма
Изделие:
«Устройство
для
проведения клинических
самостоятельного забора проб на тест
испытаний, в следствии чего
ВПЧª
не подтверждены
Клинические испытания проводились в
эффективность и
форме анализа и оценки клинических
безопасность медицинского
данных.
изделия
Изделие:
«Набор
реагентов
«Диагностикум
эритроцитарный
сальмонеллезный
Ви-антигенный
Результаты проведенных
жидкий»
клинических испытаний не
Клинические испытания набора проводились
подтверждают эффективность
с помощью сывороток иммунизированных
медицинского изделия
кроликов. На клинические испытания не
были предоставлены положительные
образцы сывороток крови человека,
содержащие антитела к Ви-антигену
сальмонелл тифа (S. Typhi).
160
Причины для отказа при проведении экспертизы
Основание
Пример
Представленные результаты
1.
Отсутствуют табулированные данные
клинических испытаний не
полученных значений и их статистическая
подтверждают
обработка
эффективность
(в соответствии с Приложением
5
Приказа
медицинского изделия
Минздрава России № 2н).
2.
Отсутствует
оценка
показателей
клинической эффективности МИ с учетом
статистической обработки полученных данных
(не указана доверительная вероятность и/или
объем выборки, на которой данные
характеристики получены).
161
Причины для отказа при проведении экспертизы
Основание
Пример
Клинические
Инструменты зондирующие, бужирующие для
испытания
лапароскопических операций
считаются
В результате проведения клинических испытаний
отрицательным
выявлены побочные действия (нежелательные реакции
и и не являются
при применении) возможные при использовании с
доказательство
источниками энергии, сведения о которых отсутствуют в
м безопасности
эксплуатационной документации производителя.
и
Согласно п. 45 Порядка проведения оценки соответствия
эффективность
медицинских изделий в форме технических испытаний,
медицинского
токсикологических
исследований,
клинических
изделия
испытаний в целях государственной
регистрации
медицинских изделий, утвержденного Приказом
Минздрава России от 09.01.2014 № 2н, результаты таких
клинических испытаний медицинского изделия считаются
отрицательными и, соответственно, не могут являться
доказательством эффективности и безопасности
медицинского изделия.
162
Причины для отказа при проведении экспертизы
Основание
Пример
Клинических
Клинический отчет содержит сведения о летальных
испытаний
исходах по результатам применения изделия,
считаются
информация о которых отсутствует в документации
отрицательными
производителя.
и не являются
Согласно п.
45
Порядка проведения оценки
доказательством
соответствия
медицинских изделий в форме
безопасности и
технических
испытаний,
токсикологических
эффективность
исследований, клинических испытаний в целях
медицинского
государственной регистрации медицинских изделий,
изделия
утвержденного Приказом Минздрава России от
09.01.2014
№ 2н, результаты таких клинических
испытаний медицинского изделия считаются
отрицательными и, соответственно, не могут
являться доказательством эффективности и
безопасности медицинского изделия.
163