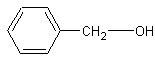
Спирты и их свойства
· Спирты,
· Простые эфиры,
· Альдегиды,
· Кетоны,
· Карбоновые кислоты, их ангидриды и галогенангидриды
· Сложные эфиры,
· Фенолы и их простые эфиры.
К спиртам относятся соединения, содержащие функциональную группу -OH, связанную с алифатическим радикалом.
Например, CH2=CH-CH2-OH, HC≡C-CH2-OH, CH3-OH.
аллиловый спирт пропаргиловый спирт метанол
В радикал, соединенный с группой –OH, может входить так же остаток ароматического углеводорода, если он отделён, по крайней мере, одной метиленовой группой.

![]()
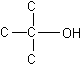
I. ![]() По
типу атомов углерода, контактирующих с функциональной группой –OH
различают первичные , вторичные и
третичные спирты.
По
типу атомов углерода, контактирующих с функциональной группой –OH
различают первичные , вторичные и
третичные спирты.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Исключение: CH3-OH (метанол) –он тоже первичный спирт.
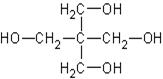
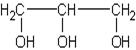
II. По количеству гидроксильных групп различают одноатомные, трёхатомные, многоатомные, полиатомные спирты, например:
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()


![]()
![]()
![]()
![]()
Номенклатура и изомерия спиртов
По номенклатуре ИЮПАК в структурной формуле спирта находится самая длинная цепь из атомов углерода, обязательно включающая атом углерода, связанный с гидроксильной группой. Эта цепь нумеруется с той стороны, к которой ближе гидроксил. Сначала называются алкильные радикалы с указанием их места положения в цепи, затем название алкана соответствующего длине выбранной цепи, после чего добавляется окончание спиртов – «ол».
По рациональной номенклатуре атом углерода и связанный с ним гидроксил получают название «карбинол». Сначала называются алкильные радикалы, соединённые с упомянутым выше атомом углерода, а затем слитно слово «карбинол». Ниже в таблице приведены названия спиртов с брутто-формулой С5Н12О по этим видам номенклатур, а также тривиальные (то есть исторически сложившиеся) их названия.
|
C5H12O |
Название по ИЮПАК |
Рациональное название |
Тривиальное название |
|
|
Пентанол - 1 |
н- Бутилкарбинол |
Амиловый спирт |
|
|
Пентанол - 2 |
Метилпропилкарбинол |
- |
|
|
Пентанол - 3 |
Диэтилкарбинол |
- |
|
|
2 – метилбутанол - 1 |
Втор - бутилкарбинол |
- |
|
|
2 - метилбутанол - 2 |
Диметилэтилкарбинол |
Трет – амиловый спирт |
|
|
3 – метилбутанол - 2 |
Метилизопропилкарбинол |
- |
|
|
3 – метилбутанол - 1 |
Изобутилкарбинол |
Изоамиловый спирт |
|
|
2,2 – диметилпропа- нол - 1 |
Трет - бутилкарбинол |
Неопентиловый спирт |
Контрольное задание: написать структурные формулы спиртов C6H14O и дать им названия по номенклатуре ИЮПАК и по рациональной номенклатуре.
Способы получения спиртов
1. Из алканов. Метан может быть селективно окислен на гетерогенном катализаторе – серебре расчётным количеством кислорода до метанола:
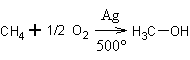
Алканы с большим числом атомов углерода ,такие, например, как пропан и бутан, окисляются до смеси первичных и вторичных спиртов расчётным количеством кислорода в присутствии катализаторов – солей марганца. Реакция малоселективна – получается довольно большое количество примесей: альдегидов и кетонов с тем же числом атомов углерода, альдегидов и спиртов – продуктов деструкции

2. Из алкенов. К любому алкену можно присоединить воду в присутствии кислот

Присоединение идёт по правилу Марковникова.
3. Из алкинов. Ацетилен и терминальные алкины, реагируя с формальдегидом, другими альдегидами и кетонами, дают соответственно первичные, вторичные и третичные спирты

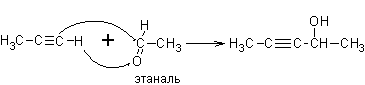

Реакции были впервые опубликованы в 1905 году А.Е. Фаворским и носят его имя.
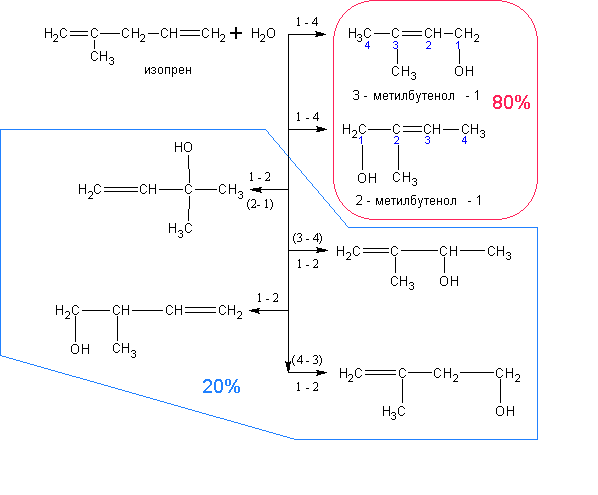
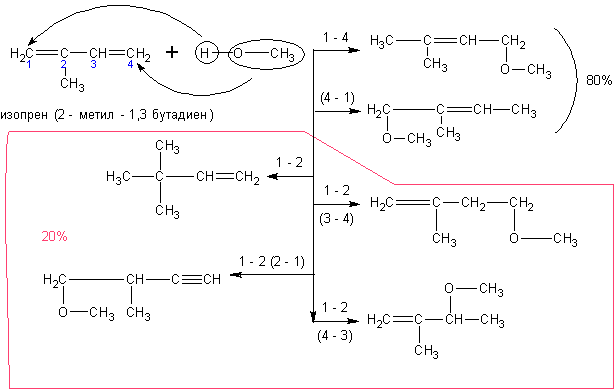
4. Из алкадиенов. Алкадиены аналогично алкенам присоединяют в присутствии кислот воду.
Присоединение первого моля воды идёт преимущественно в положения 1 – 4. При
присоединении второго моля воды образуются диолы. Ниже представлены примеры обоих
случаев:

5. Из галоидных алкилов. Галоидные алкилы вступают с водными растворами щелочей в реакцию нуклеофильного замещения галогена на гидроксил:

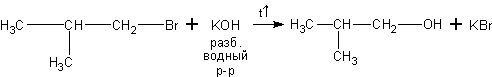
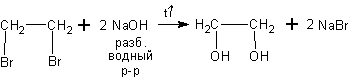 6.
Из дигалоидных производных.
При действии щелочей на дигалоидные производные алканов получаются
двухатомные спирты (или диолы):
6.
Из дигалоидных производных.
При действии щелочей на дигалоидные производные алканов получаются
двухатомные спирты (или диолы):
Как показано выше из 1,2-дибромэтана получается 1,2-этандиол (этиленгликоль). Этот диол очень широко применяется для производства антифризов. Например, в незамерзающей жидкости для охлаждения двигателей внутреннего сгорания – «Тосол-А 40» его 40%.
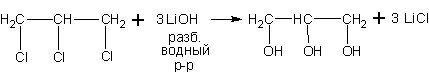 7.
Из тригалоидных производных. Из
1,2,3-трихлорпропана, например, получают широко используемый глицерин
(1,2,3-пропантриол).
7.
Из тригалоидных производных. Из
1,2,3-трихлорпропана, например, получают широко используемый глицерин
(1,2,3-пропантриол).
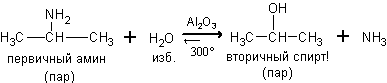 8.
Из аминов. При
нагревании с парами воды в присутствии катализатора протекает обратимая реакция,
в которой конечными продуктами являются спирт с тем же строением углеродного
скелета и аммиак.
8.
Из аминов. При
нагревании с парами воды в присутствии катализатора протекает обратимая реакция,
в которой конечными продуктами являются спирт с тем же строением углеродного
скелета и аммиак.
Первичные амины можно перевести в спирты так же действием нитрита натрия в соляной кислоте при охлаждении до 2 – 5оС:
![]()
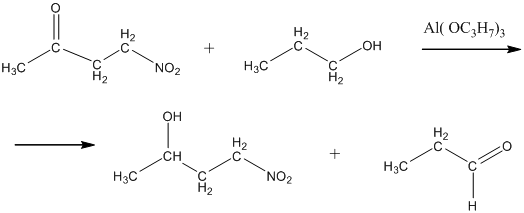
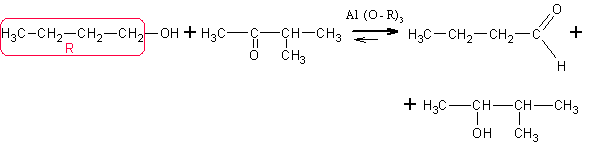 9.
Из альдегидов и кетонов по реакции Меервейна – Понндорфа – Верлея. На
кетон или альдегид действуют каким-либо спиртом в присутствии катализатора –
алкоголята алюминия. В качестве алкоксильных групп берут остатки того же спирта,
который взят в качестве реагента. Например, в приведённой ниже реакции вместе с
нормальным бутиловым спиртом взят трибутилат алюминия. Реакция обратима и
равновесие в ней сдвигают по принципу Ле-Шателье избытком спирта-реагента.
9.
Из альдегидов и кетонов по реакции Меервейна – Понндорфа – Верлея. На
кетон или альдегид действуют каким-либо спиртом в присутствии катализатора –
алкоголята алюминия. В качестве алкоксильных групп берут остатки того же спирта,
который взят в качестве реагента. Например, в приведённой ниже реакции вместе с
нормальным бутиловым спиртом взят трибутилат алюминия. Реакция обратима и
равновесие в ней сдвигают по принципу Ле-Шателье избытком спирта-реагента.
Первые публикации об этой реакции появились практически одновременно в двух разных немецких и одном французском химических журналах в 1925 – 1926 годах. Реакция имеет огромное значение, так как позволяет восстановить карбонильную группу в спиртовую, не восстанавливая двойные связи, нитро- и нитрозогруппы, которые водородом и другими восстановителями переводятся соответственно в простые связи и аминогруппы, например:

Как видно двойная связь, присутствовавшая в кетоне, сохранилась и в полученном спирте. Ниже показано, что при гидрировании кетогруппы одновременно гидрируется и двойная связь.

Аналогичная картина наблюдается и при наличии в кетоне нитрогруппы: в реакции Меервейна –Понндорфа-Верлея она сохраняется, а при гидрировании водородом на катализаторе восстанавливается до аминогруппы:
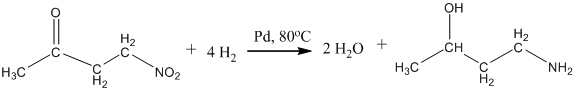
10. Из альдегидов и кетонов путём гидрирования на катализаторах – металлах платиновой группы: Ni, Pd, Pt :


11. Получение спиртов из альдегидов и кетонов путём синтезов Гриньяра.
Реакции, открытые Франсуа Огюстом Виктором Гриньяром в 1900 – 1920 годах имеют колоссальное значение для синтезов многих классов органических веществ. Так, например, с их помощью можно из любого галоидного алкила и формальдегида в три стадии получить первичный спирт:
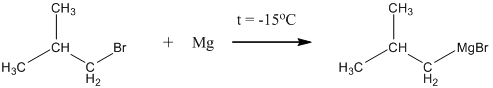 (1)
(1)
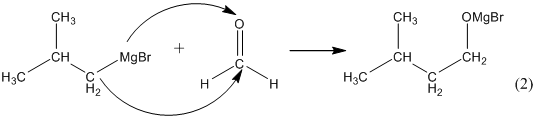
Для получения вторичного спирта надо вместо формальдегида взять любой другой альдегид:

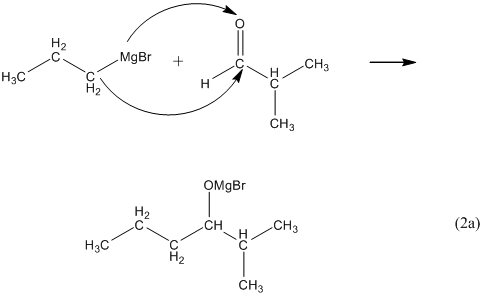
При гидролизе такой соли получается спирт с числом атомов углерода равным сумме их в магнийорганическом соединении и в альдегиде:

Для получения третичного спирта вместо альдегида в синтезе используют кетон:

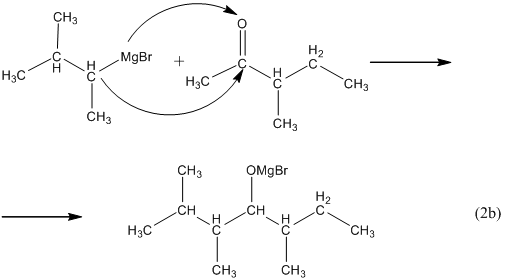
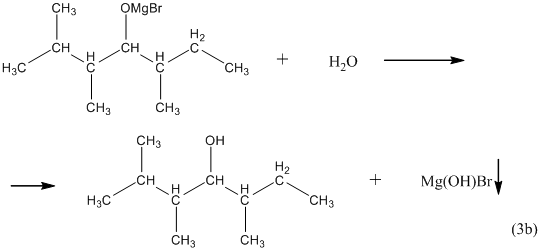
12. Из карбоновых кислот спирты можно получить только в две стадии: на первой из карбоновой кислоты действием пентахлорида фосфора или действием оксиддихлорида серы (IV) получают её хлорангидрид:
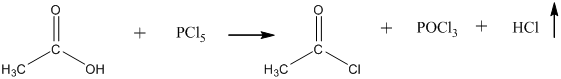
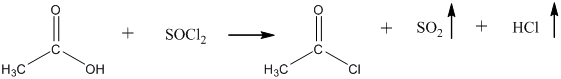
На второй стадии, полученный хлорангидрид гидрируют на палладии до спирта:
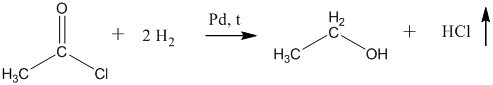
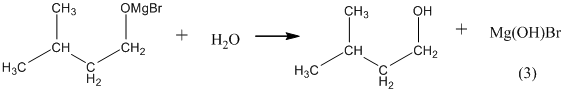
13. Из алкоголятов спирты очень легко получаются путём гидролиза при комнатной температуре:


Борные эфиры гидролизуются труднее – только при нагревании:
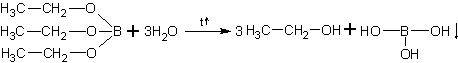
|
|
Выпадает в осадок если её больше, чем 4г/100г H2O
14. Из сложных эфиров спирты наряду с карбоновыми кислотами могут быть получены путём автокаталитического, кислотного или щелочного гидролиза. При автокаталитическом процессе в результате очень медленного гидролиза водой появляется слабая карбоновая кислота, которая в дальнейшем ходе реакции играет роль катализатора, заметно ускоряя расход сложного эфира и появление спирта во времени. Например, для реакции втор-бутилового эфира 2-метилпропановой кислоты кинетические кривые, то есть зависимости изменения молярных концентраций во времени представяют собой сигмоиды или S-образные кривые (смотрите график ниже реакции).
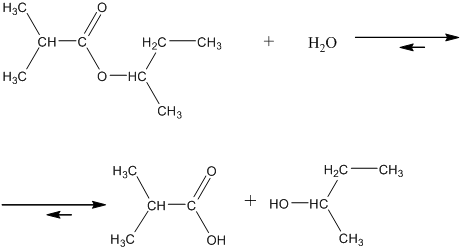

15. Если добавить к сложному эфиру сильную кислоту, которая является катализатором, то в
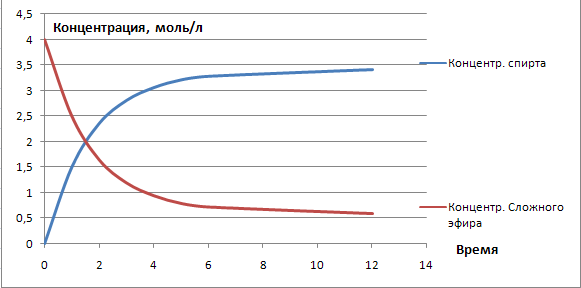
реакции не будет индукционного периода, когда гидролиз почти не идёт (от 0 до 1 времени).
Кинетические кривые в этом случае будут представлять собой экспоненты: нисходящую
для сложного эфира и восходящую для спирта. Процесс называется кислотным гидролизом:
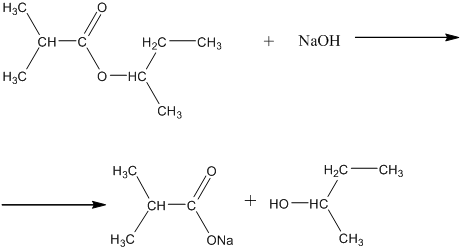
16. Если добавить к сложному эфиру щёлочь (моль на моль или избыток) , то реакция так же описывается экспоненциальными кинетическими кривыми, но в отличие от кислотного гидролиза, где концентрации веществ стремятся к равновесным значениям, здесь конечная концентрация спирта практически равна исходной концентрации эфира. Ниже приведена реакция щелочного гидролиза того же сложного эфира и график с кинетическими кривыми. Как видно щёлочь здесь не катализатор, а реагент, и реакция необратима:

17. Из сложных эфиров спирты можно получить также по Буво и Блану. Этот способ был впервые опубликован авторами в двух разных французских химических журналах в 1903 и 1906 годах и заключается в восстановлении сложных эфиров натрием в спирте, например:

Как видно в реакции получаются два спирта: один из кислотной части сложного эфира и он всегда первичный, второй из спиртовой части и он может быть любым – первичным, вторичным или третичным.
18. Более современный способ получения спиртов из сложных эфиров заключается в восстановлении их комплексными гидридами до алкоголятов (реакция ( 1 ) ), которые затем легко переводятся в спирты путём гидролиза (реакции ( 2а ) и ( 2b ) ), например:
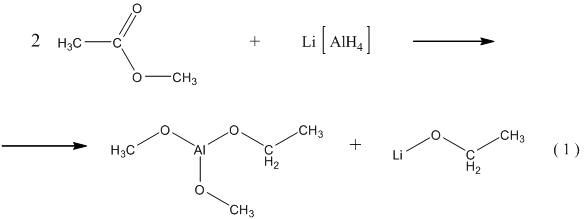

![]()
Спирты – бесцветные вещества, поглощающие свет в ближней УФ части спектра 200 < αmax < 300 нм. Среди спиртов нет газов ни при нормальных условиях, ни при комнатной температуре. Спирты линейного строения с числом атомов углерода до 12 – жидкости при комнатной температуре. Например, деканол-1 плавится при +7оС, додеканол при 24оС, а тридеканол-1 уже при 30,6оС, то есть он твёрдое вещество при комнатной температуре. Среди спиртов разветвлённого строения даже с небольшим числом атомов углерода появляются твёрдые вещества. Так, например, трет-бутиловый спирт плавится при +25,5оС, тогда как нормальный бутиловый плавится при -89,5оС, изобутиловый при -108оС, а втор-бутиловый спирт при -114,7оС.
Спирты способны образовывать межмолекулярные водородные связи.
![]()
 Образование
межмолекулярных водородных связей приводит к значительному повышению температур
кипения спиртов по сравнению с веществами, имеющими тот же радикал, но вместо
гидроксильной группы OH –
другие атомы или группы.
Образование
межмолекулярных водородных связей приводит к значительному повышению температур
кипения спиртов по сравнению с веществами, имеющими тот же радикал, но вместо
гидроксильной группы OH –
другие атомы или группы.
CH3F, CH3-Cl, CH3-Br – газы при нормальных условиях.
tкип (C2H5OH) = 78, 5°C tкип (CH3OH) = 65°C
CH3-O-CH3 – газ при комнатной температуре.

Температуры кипения у спиртов–изомеров зависят от строения; у линейных изомеров они самые высокие, у наиболее разветвлённых - самые низкие. Например, у нормального бутилового спирта tкип= 117,7оС, у изобутилового tкип= 107,9оС, а у трет-бутилового tкип= 82,8оС
Спирты – вязкие жидкости. Их вязкость превышает вязкость воды при той же температуре. Метанол, этанол и низшие спирты смешиваются с водой при любой температуре. Начиная со спиртов C4, растворимость становится ограниченной. При увеличении длины углеродной цепи растворимость жидких спиртов в воде резко падает.
Растворимость спиртов в алканах и их смесях, например, в октане или керосине, плохая. Они смешиваются в любых соотношениях с низшими кетонами (ацетоном и метилэтилкетоном). Спирты хорошо растворяются, а чаще – смешиваются в любых соотношениях с кетонами, альдегидами, сложными эфирами с близкой молярной массой. Спирты смешиваются в любых соотношениях или очень хорошо растворимы в полярных органических растворителях: формамиде, ТГФ, диоксане, ДМФА, ДМАА, гексаметаполе, ДМСО и др.
Сами спирты – полярные органические растворители. Они очень хорошо растворяют многие органические вещества: фенол, анилин, нитробензол, галогенпроизводные алканов. Хорошо или очень хорошо растворяются в спиртах также многие соли, например, некоторые из перхлоратов (ClO4-):
|
|
CH3OH |
C2H3OH |
|
|
NH4+ |
6,9 |
1,9 |
Хорошо растворяют |
|
Li+ |
188,2 |
151,8 |
Очень хорошо |
|
Na+ |
51,3 |
14,7 |
|
|
K+ |
0,21 |
0,012 |
Умеренно и плохо |
|
Rb+ |
0,06 |
0,009 |
Плохо |
|
Cs+ |
0,09 |
0,011 |
|
|
Mg2+ |
51,8 |
24,0 |
Очень хорошо |
|
Ca2+ |
237,4 |
166,2 |
Превосходно |
|
Sr2+ |
212 |
180,7 |
|
|
Ba2+ |
217,1 |
124,6 |
Растворимость перхлоратов в этой таблице указана в граммах на 100 грамм растворителя.
И метанол, и этанол хорошо растворяют нитрат серебра (AgNO3), роданид аммония (NH4NCS) и другие соли. В глицерине растворяется до 30% буры (Na2B4O7)
Метанол, этанол, пропанол–2 имеют специфический запах водки.
Спирты C4 – C5 имеют запах сивушных масел. Высшие спирты (воск) практически не пахнут. Некоторые спирты, содержащие бензольные кольца, могут хорошо пахнуть, например, 2-фенилэтанол
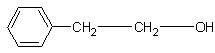 пахнет
розой, а 2,6-диметилгептанол-2 имеет тонкий цветочный запах с оттенком аромата
земляники.
пахнет
розой, а 2,6-диметилгептанол-2 имеет тонкий цветочный запах с оттенком аромата
земляники.
Химические свойства спиртов
Спирты являются очень слабыми кислотами .Их pKa = 16-18. Однако они гораздо более сильные кислоты, чем ацетилен (рКа= 22) и аммиак (рКа=35). Поэтому легко, при комнатной температуре низшие спирты реагируют с ацетиленидами щелочных металлов и с амидом натрия:
![]()
![]()
Со щелочами спирты реагируют обратимо. Равновесие сильно смещено в сторону исходных веществ, так как вода значительно более сильная кислота, чем спирты:
![]()
В связи с этим при реакциях галогенпроизводных бензола со щелочами, проводимых в спирте, получается больше продукта I, чем II, так как
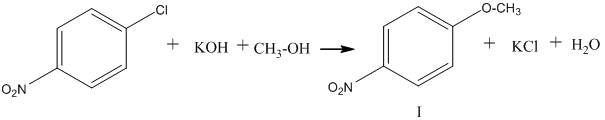
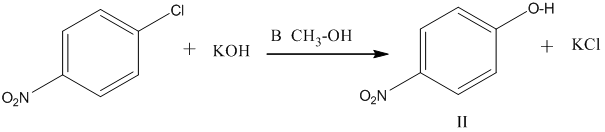
скорость реакции с метилат –ионом намного выше, чем с гидроксид-ионом, хотя последнего в равновесии больше.
Спирты могут взаимодействовать с очень многими реагентами. Ниже приведены наиболее важные из этих реакций:
Спирты реагируют с активными металлами:
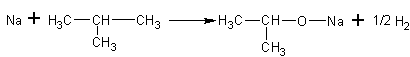
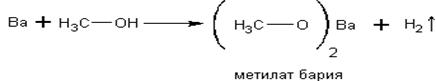
Реакции, приведённые ниже, используются для абсолютирования спиртов, то есть для удаления из них воды путём её химического связывания. К магниевым стружкам приливают
спирт, содержащий около 4% воды, и кипятят, добавляя йод для активации первой реакции:
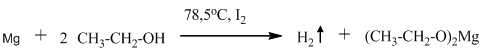
Полученный этилат магния самопроизвольно реагирует с водой – обычный гидролиз соли слабого основания и слабой кислоты:
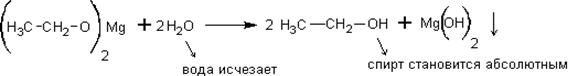
С менее активными металлами, такими как Al, Zn, Fe спирты не реагируют.
Спирты могут реагировать с концентрированными галогеноводородными кислотами в присутствии ZnCl2 (р. Лукаса):

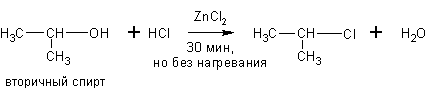
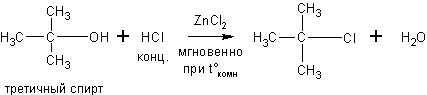
Эти реакции – хороший пример для иллюстрации положения теории А.М.Бутлерова о влиянии строения на химические свойства. Как видно скорость реакции с одним и тем же реагентом в случае третичных спиртов намного выше, чем для вторичных, а те в свою очередь реагируют быстрее первичных.
С кислородсодержащими кислотами спирты реагируют с образованием сложных эфиров этих кислот:
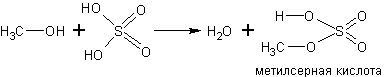
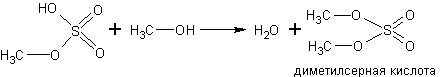
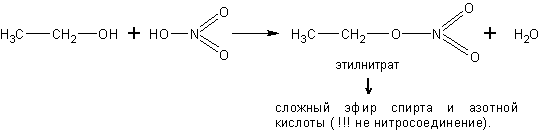
Спирты реагируют с аммиаком. Реакция обратима. Равновесие в ней смещают вправо избытком аммиака в соответствии с принципом Ле-Шателье:
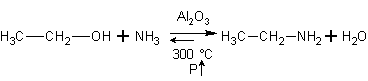
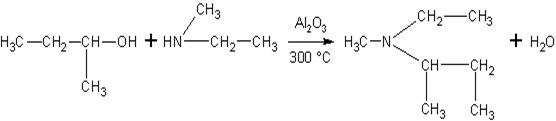
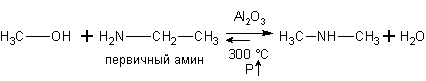 Спирты реагируют с
аминами.
Спирты реагируют с
аминами.
При межмолекулярной дегидратации спиртов образуются простые эфиры:

 При
дегидратировании в газовой фазе на гетерогенном катализаторе – оксиде алюминия
равновесие смещают вправо, понижая давление, так как
в реакции из одного моля
газа получается
два (в
соответствии с принципом Ле-Шателье)
При
дегидратировании в газовой фазе на гетерогенном катализаторе – оксиде алюминия
равновесие смещают вправо, понижая давление, так как
в реакции из одного моля
газа получается
два (в
соответствии с принципом Ле-Шателье)
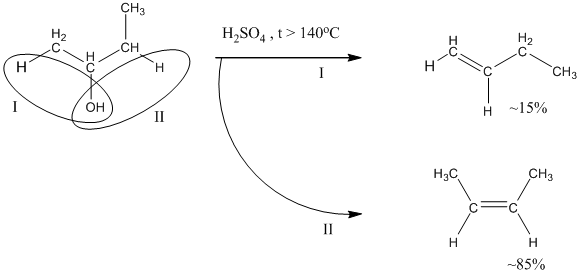
При внутримолекулярной дегидратации получаются алкены. В соответствии с правилом Зайцева водород преимущественно отщепляется от менее гидрогенизированного атома углерода из двух соседних с тем атомом углерода, который связан с гидроксилом
Спирты взаимодействуют с непредельными углеводородами:
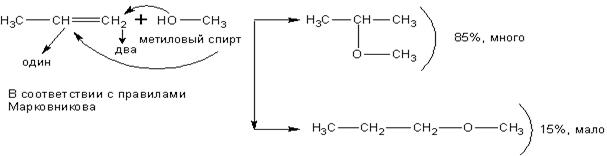
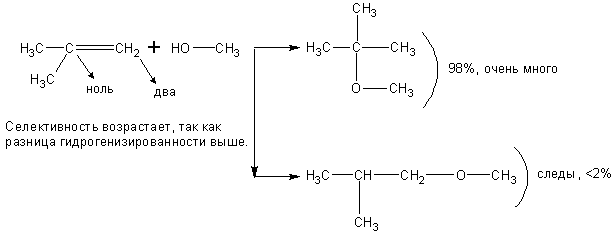
При реакции спиртов с ацетиленом получаются очень важные для синтеза полимеров виниловые эфиры:
![]()
Алкадиены со спиртами так же дают непредельные простые эфиры:
С аренами спирты не реагируют. Они не реагируют также с галогенпроизводными алканов. Однако соли спиртов – алкоголяты реагируют с ними очень легко. В результате реакции получаются простые эфиры (лучший способ получения несимметричных простых эфиров):
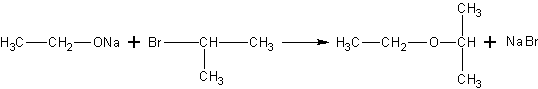
 Реакция спиртов
с альдегидами (получение
полуацеталей).
Реакция спиртов
с альдегидами (получение
полуацеталей).
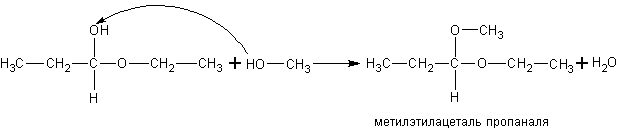 При
реакции спиртов с полуацеталями получаются ацетали:
При
реакции спиртов с полуацеталями получаются ацетали:
Полуацетали и ацетали, как правило, обладают хорошим запахом, выделяются из растений и часто служат компонентами парфюмерных композиций.
Реакция спиртов с кетонами аналогична их взаимодействию с полуацеталями, но проходит в более жестких условиях.
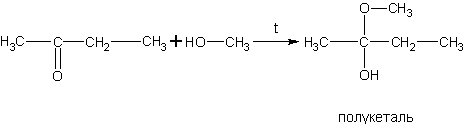

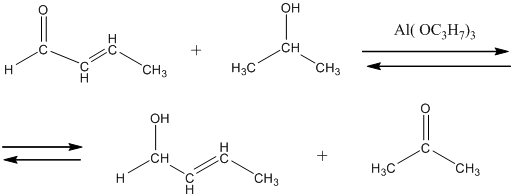
Спирты взаимодействуют с альдегидами и кетонами по реакции Меервейна – Понндорфа – Верлея, о которой было подробно рассказано в пункте 9 способов получения спиртов. Здесь приведём другой пример этой реакции:
 Спирты взаимодействуют
также и с карбоновыми кислотами.
При этом обратимо получаются сложные эфиры и вода. Процесс называется реакцией
этерификации.
Спирты взаимодействуют
также и с карбоновыми кислотами.
При этом обратимо получаются сложные эфиры и вода. Процесс называется реакцией
этерификации.
Спирты могут взаимодействовать также со сложными эфирами. Получается новый спирт и новый сложный эфир. Реакция носит характер обратимой , катализируется кислотами и называется реакцией переэтерификации спиртом. Она очень широко применяется в синтезах душистых веществ для парфюмерных композиций.

Спирты могут окисляться в различных условиях до различных продуктов:
а) При горении:
![]()
б) При окислении паров первичных и вторичных спиртов оксидом меди получаются соответственно альдегиды и кетоны, например:
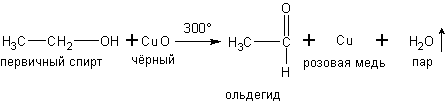
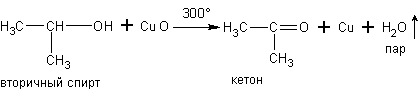
в) При дегидрировании спиртов на катализаторах платиновой группы первичные спирты окисляются до альдегидов, а вторичные - до кетонов:

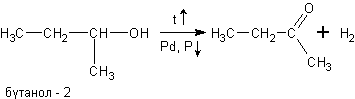
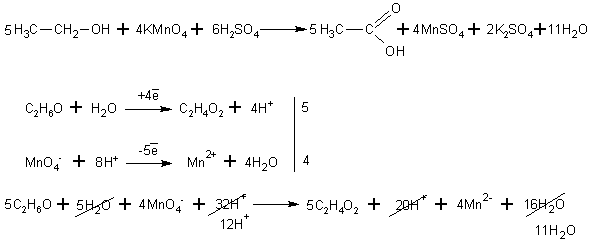
При окислении спиртов в жидкой фазе в кислой среде сильными окислителями, такими как перманганат калия, дихромат калия или висмутат натрия первичные спирты окисляются до карбоновых кислот. Вторичные - до кетонов. Например, этанол до уксусной кислоты:
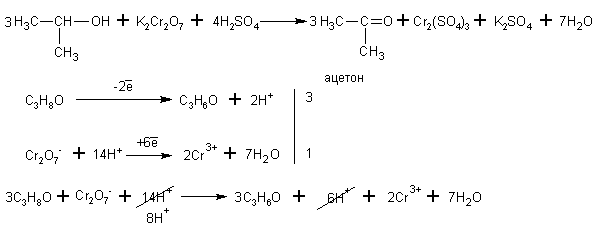
Изопропиловый спирт окисляется до кетона (до пропанона )
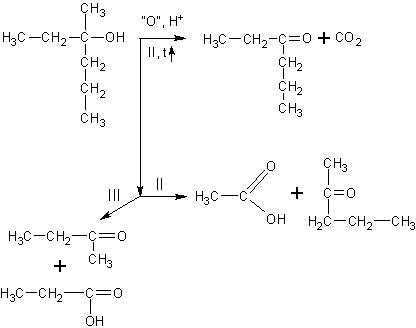 Окисление третичных
спиртов идет
Окисление третичных
спиртов идет
только при нагревании с разрывом C-C связи. Получается сложная смесь карбоновых кислот, кетонов и углекислый газ:
Если все алкильные радикалы одинаковы, то реакция может быть уравнена. Ниже приведена реакция окисления третичного спирта – триэтилкарбинола висмутатом натрия в среде разбавленной азотной кислоты:

Наряду со способами аналогичными способам получения одноатомных спиртов, двухатомные спирты могут быть получены путём окисления алкенов по Вагнеру, например:

При присоединении воды к
эпоксисоединениям так же
получаются диолы: 
Трёхатомный спирт – глицерин может быть получен, например, по приведённой ниже цепи превращений:

Двух- и многоатомные спирты вступают во все те же реакции, в которые вступают одноатомные спирты, правда реакция может идти ступенчато, например:
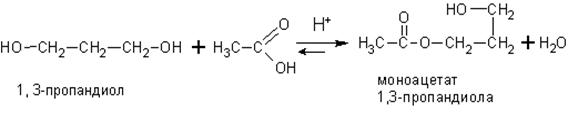
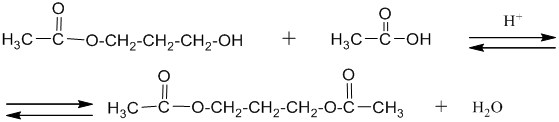
При взаимодействии многоатомных спиртов с гидроксидами тяжелых металлов, таких как хром, свинец , висмут и медь в щелочной среде образуются хорошо растворимые в воде комплексные соединения. Медный комплекс ярко окрашен в сине-фиолетовый цвет. Для образования комплексов необходимо, чтобы гидроксильные группы в спиртах находились у соседних атомов углерода.

Незаряженные комплексы такого типа могут из водного раствора переходить в органические растворители , например, в 1,2-дихлорэтан или в хлороформ.
В трёхатомных спиртах, а так же и в спиртах с большим количеством гидроксильных групп, в образовании комплекса участвуют только два стоящих рядом гидроксила. Например, в комплексе из глицерина и катиона меди (II):

ПРИМЕНЕНИЕ И МЕДИКО-БИОЛОГИЧЕСКОЕ
ЗНАЧЕНИЕ СПИРТОВ
Простейший спирт – метанол очень широко применяется как исходное сырьё в многочисленных органических синтезах. Например, для синтеза формальдегида, метилмеркаптана, метиламина, сложных эфиров многих карбоновых кислот, которые в свою очередь применяются как пластификаторы, растворители, душистые вещества в парфюмерии и компоненты пищевых эссенций. Очень важным является синтез уксусной кислоты из метанола и угарного газа:
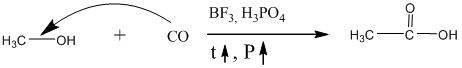
Этот способ производства уксусной кислоты вытеснил вредный с позиции экологии способ её синтеза из ацетилена через ацетальдегид по Кучерову, так как в нём получается большое количество ртутьсодержащих сточных вод.
Не менее важным является использование метанола в синтезе метилакрилата из ацетилена , угарного газа и этого спирта:
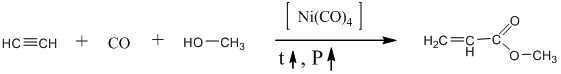
Метанол используется также как растворитель, антифриз и моторное топливо. Им растворяют пробки, образующиеся из замёрзшего конденсата в газопроводах на крайнем севере.
Метанол чрезвычайно токсичен. 7- 10 мл его достаточно для того, чтобы мужчина с массой тела около 70 кг ослеп. Выпитые по ошибке 25 – 30 мл приводят к летальному исходу. Важно знать, что токсичен не сам метанол, а продукты его окисления под действием ферментов – формальдегид и муравьиная кислота. Поэтому, если занять ферменты окислением гораздо менее опасного для человека этанола (в виде водки, принимаемой постоянно в течение трёх суток), то пациента можно спасти.
В мире производится около 30 миллионов тонн метанола в год.
Этанол применяется в производстве ацетальдегида, хлороформа, диэтилового эфира, этилацетата, уксусной кислоты, дивинила, многих душистых веществ для парфюмерии. Кроме того он применяется как растворитель лакокрасочных материалов, взрывчатых и лекарственных веществ. Этиловый спирт, получаемый путём брожения пищевого сырья, применяется при изготовлении алкогольных напитков, растворения и перекристаллизации лекарственных препаратов. Этанол – наркотик, возбуждающе действующий на организм; его постоянное (важно знать любителям пива) или периодическое, но неумеренное употребление ведёт к алкоголизму – тяжёлой болезни, заканчивающейся циррозом печени и полной деградацией личности. В мире производится около 3 миллионов тонн этанола в год.
Пропанол-1 широко применяется как растворитель для восков, природных и синтетических смол. Как исходное вещество в синтезе лекарственных препаратов, душистых веществ для парфюмерных композиций, сложных эфиров – растворителей лакокрасочных материалов, пестицидов.
Пропанол-2 широко применяется как растворитель ацетатов целлюлозы, этилцеллюлозы, целлофана, эфирных масел, алкалоидов. Как исходное вещество он применяется в синтезах ацетона, изорпопиламина, изопропилацетата , косметических, моющих и лекарственных средств.
Изопропиловый спирт входит в состав жидкостей для размораживания замков и в состав «жидкого ключа», помогающего отворачивать гайки, например, на колёсах автомобилей.
Бутанол-1 применяется как растворитель лакокрасочных материалов, как исходное вещество в синтезе душистых веществ для парфюмерных композиций, пластификаторов для полимерных материалов, гербицидов.
Бутанол-2 применяется как высокооктановый ( ОЧ = 110 ) компонент моторных топлив, как исходное вещество в синтезах. В мире производится около 1 миллиона тонн бутанола-2 в год.
Изобутиловый спирт ( 2-метилпропанол-1 ) применяется как растворитель лакокрасочных материалов и азотнокислых эфиров целлюлозы (взрывчатые вещества, ракетное топливо). Он используется так же в синтезах душистых веществ, пластификаторов для полимеров, гербицидов.
Трет-бутиловый спирт ( 2-метипропанол-2 )в огромных масштабах используется для получения путём дегидратации изобутилена ( 2-метилпропена ), который идёт как мономер для производства полиизобутилена. Последний с малой степенью полимеризации ( 15 – 50 ) служит как присадка к моторным маслам, а с большой (десятки тысяч) как материал для защиты от коррозии аппаратов большого объёма в химической промышленности. Трет-бутиловый спирт используется так же в производстве инициаторов полимеризации.
Высшие спирты ( С6 – С20 ) применяются по-разному в зависимости от длины углеродной цепи. Спирты ( С6 – С8 ) как флотореагенты, как экстрагенты солей Co, V и U, как растворители для синтетических смол, как сырьё в производстве пластификаторов. Спирты ( С10 – С20 ) как компоненты пеногасителей, смазочно-охлаждающих жидкостей, текстильно-вспомогательных веществ, косметических составов. Метакриловые эфиры спиртов ( С7 – С9 ) как депрессорные присадки к моторным топливам и маслам. Натровые и аммонийные соли сернокислых эфиров спиртов ( С10 – С20 ) как синтетические моющие средства, способные стирать в жёсткой и морской воде.
Этиленгликоль ( 1,2-этандиол ) очень широко применяется как компонент антифризов для охлаждения двигателей внутреннего сгорания. Эти антифризы обеспечивают хороший отвод тепла на рабочих режимах двигателя и не замерзают при отрицательных температурах, как вода. Отечественная промышленность выпускает антифризы «Тосол –А 40» и «Тосол –А 60». Первый содержит 40% этиленгликоля и 60% воды и предназначен для работы в средней полосе России, а второй содержит 60% этиленгликоля и 40% воды и используется на крайнем севере. Кроме того этиленгликоль широко применяется в синтезе полиэтилентерефталата, из которого производят волокно лавсан ( за границей терилен, дакрон, ямболен и другие ). Из этиленгликоля получают так же многочисленные сложные эфиры. Например, дибутиловый эфир этиленгликоля используют как реагент для выделения Bi(III), Po(IV) и U(IV) из водных растворов. Этиленгликоль входит так же в состав гидравлических, тормозных и закалочных жидкостей. В мире производится около 20 миллионов тонн этиленгликоля в год.
Глицерин ( 1,2,3-триоксипропан, 1,2,3-пропантриол ) применяется для производства тринитрата 1,2,3-пропантриола, неправильно называемого нитроглицерином. Нитрогглицерин одновременно является взрывчатым веществом и препаратом для снятия сердечных приступов.
Глицерин является сырьём в производстве алкидных смол, акролеина, полиуретанов. Он входит в состав эмульгаторов, моющих средств, антифризов, косметических и парфюмерных препаратов, медицинских мазей и растворов, кремов для обуви. В некоторых алкогольных напитках до 15%
глицерина. Глицерин абсолютно не токсичен. В виде фрагмента он входит в состав всех жиров и некоторых других липидов.
Пентаэритрит (2,2-диметилол-1,3-пропандиол) широко применяется как исходное вещество в синтезе синтетических смазочных масел повышающих моторесурс турбозубчатых агрегатов в 5 – 6 раз. Он является также сырьём в производстве алкидных смол, тетранитропентаэритрита, поверхностно-активных веществ и пластификаторов.
Поливиниловый спирт применяется в производстве волокон для хирургии, как компонент кровезаменяющих составов и некоторых готовых выпускных форм, например, «йодинола», как эмульгатор. В мире производится около 1 миллиона тонн поливинилового спирта в год.
Содержание
Кислородсодержащие органические соединения………………………………………………………………..1 Спирты. Определение……………………………………………………………………………………………………………..1
Классификация спиртов:
по типу атомов углерода, контактирующих с функциональной группой «ОН»……………………1
по количеству гидроксильных групп ……………………………………………………………………………………..2
Номенклатура и изомерия спиртов ……………………………………………………………………………………….2
Способы получения спиртов:
1. Из алканов…………………………………………………………………………………………………………………….4
2. Из алкенов…………………………………………………………………………………………………………………….4
3. Из алккинов…………………………………………………………………………………………………………………..4
4. Из алкадиенов………………………………………………………………………………………………………………5
5. Из галоидных алкилов………………………………………………………………………………………………….6
6. Из дигалоидных производных…………………………………………………………………………………….7
7. Из тригалоидных производных……………………………………………………………………………………7
8. Из аминов……………………………………………………………………………………………………………………..7
9. Из альдегидов и кетонов по реакции Меервейна-Понндорфа-Верлея……………………..7
10. Из альдегидов и кетонов путём гидрирования в присутствии катализаторов………….9
11. Из альдегидов и кетонов и галоидных алкилов путём синтезов Гриньяра…………….11
12. Из карбоновых кислот через галогенангидриды, которые гидрируют……………………11
13. Из алкоголятов……………………………………………………………………………………………………………12
14. Из сложных эфиров путём автокаталитического гидролиза…………………………………….13
15. Из сложных эфиров путём кислотного гидролиза…………………………………………………….13
16. Из сложных эфиров путём щелочного гидролиза…………………………………………………….14
17. Из сложных эфиров восстановлением по Буво и Блану……………………………………………15
18. Из сложных эфиров восстановлением комплексными гидридами…………………………15
Физические свойства спиртов…………………………………………………………………………………………16
Отношение спиртов к свету…………………………………………………………………………………………….16
Агрегатное состояние спиртов при различных температурах……………………………………….16
Зависимость температур плавления спиртов-изомеров от строения…………………………..16
Межмолекулярные водородные связи в спиртах………………………………………………………….17
Влияние водородных связей в спиртах на их физические свойства……………………………..17
Зависимость температур кипения спиртов-изомеров от строения……………………………….17
Вязкость спиртов………………………………………………………………………………………………………………17
Растворимость спиртов в воде и органических растворителях……………………………………..17
Спирты как растворители органических и неорганических веществ…………………………….18
Запах спиртов…………………………………………………………………………………………………………………..18
Химические свойства спиртов…………………………………………………………………………………………18
Спирты как слабые кислоты…………………………………………………………………………………………….19
Реакция спиртов с ацетиленидами металлов…………………………………………………………………19
Реакция спиртов с амидами щелочных металлов………………………………………………………….19
Реакция спиртов со щелочами……………………………………………………………………………………….19
Активированное нуклеофильное замещение атомов галогенов в ароматическом
ядре равновесной смесью спиртов и их алкоголятов……………………………………………………19
Реакция спиртов с активными металлами……………………………………………………………………..19
Абсолютирование этанола………………………………………………………………………………………………19
Гидролиз алкоголятов……………………………………………………………………………………………………..20
Реакция спиртов с концентрированными галогеноводородными кислотами
( реактивом Лукаса )………………………………………………………………………………………………………..20
Реакция спиртов с кислородсодержащими неорганическими кислотами…………………..20
Реакция спиртов с аммиаком и аминами……………………………………………………………………….21
Межмолекулярная дегидратация спиртов…………………………………………………………………….21
Внутримолекулярная дегидратация спиртов…………………………………………………………………22
Реакция спиртов с алкенами…………………………………………………………………………………………..22
Реакция спиртов с ацетиленом……………………………………………………………………………………….23
Реакция спиртов с алкадиенами……………………………………………………………………………………23
Реакции алкоголятов с галоидными алкилами……………………………………………………………..23
Реакция спиртов с альдегидами…………………………………………………………………………………….23
Реакция спиртов с полуацеталями………………………………………………………………………………..24
Реакция спиртов с кетонами………………………………………………………………………………………….24
Реакция спиртов с полукеталями…………………………………………………………………………………..24
Реакция спиртов с альдегидами и кетонами по Меервейну-Понндорфу-Верлею……..24
Реакция спиртов с карбоновыми кислотами – реакция этерификации………………………25
Реакция спиртов со сложными эфирами – реакция переэтерификации…………………….25
Горение спиртов…………………………………………………………………………………………………………….25
Окисление первичных спиртов до альдегидов…………………………………………………………….25
Окисление вторичных спиртов до кетонов……………………………………………………………………25
Дегидрирование первичных спиртов до альдегидов…………………………………………………..26
Дегидрирование вторичных спиртов до кетонов…………………………………………………………26
Окисление спиртов сильными окислителями в жидкой фазе в кислой среде…………..26
Особенности способов получения и реакционной способности двух- и много-
атомных спиртов…………………………………………………………………………………………………………….27
Получение диолов из алкенов по Вагнеру…………………………………………………………………….27
Получение диолов из эпоксидных соединений…………………………………………………………….28
Получение глицерина из простых и неорганических веществ……………………………………..28
Ступенчатая этерификация диолов карбоновыми кислотами………………………………………28
Образование комплексных соединений из гидроксидов тяжёлых металлов
и двух- или трёхатомных спиртов…………………………………………………………………………………..29
Применение и медико-биологическое значение спиртов……………………………………………29
Применение метанола и его токсические свойства………………………………………………………29
Применение этанола, его токсические свойства и медико-биологическое значение…………………………………………………………………………………………………………………………..30
Применение пропанола-1 ……………………………………………………………………………………………..30
Применение пропанола-2……………………………………………………………………………………………….30
Применение бутанола-1 ………………………………………………………………………………………………..30
Применение бутанола-2 …………………………………………………….…………………………………………..30
Применение изобутилового спирта……………………..…………………………………………………………31
Применение трет-бутилового спирта……………………..……………………………………………………31
Применение высших спиртов……………………..………..…………………………………………………………31
Применение этиленгликоля…………………………………………………………………………………………….31
Применение и медико-биологическое значение глицерина………………………….……….…….31
Применение пентаэритрита…………………………………………………………………………………………….31
Применение поливинилового спирта и его и медико-биологическое значение………….32
Содержание………………………………………………………………………………………………………………………32